死亡风险较曲妥珠单抗降低24%!FDA批准Fc改造HER2单抗上市
12月16日,MacroGenics公司宣布FDA批准Margenza(margetuximab-cmkb)上市申请,联合化疗治疗成人转移性HER2阳性乳腺癌,这些患者之前至少已接受过两种或更多抗HER2治疗方案,其中至少有一种治疗方案用于转移性乳腺癌。Margenza是MacroGenics公司产品管线中首个获批药物,此次获批是基于一项代号为SOPHIA的
维迪西妥单抗获CDE突破性治疗认可,有望填补HER2阳性尿路上皮癌治疗空白
12月28日,荣昌生物开发的抗体偶联药物(ADC)维迪西妥单抗(disitamab vedotin,RC48-ADC)被CDE正式授予突破性疗法资格。适应症为既往经过化疗失败后进展的HER2过表达局部晚期或转移性尿路上皮癌患者(包括膀胱、输尿管、肾盂及尿道来源)。针对该适应症,美国FDA在9月21日已经授予了维迪西妥单抗突破性疗法认可。
百济神州引进产品注射用贝林妥欧单抗在中国获批
12月8日,百济神州宣布NMPA已批准倍利妥(注射用贝林妥欧单抗)用于治疗成人复发或难治性(R/R)前体B细胞急性淋巴细胞白血病(ALL)。此项生物制品上市许可申请(BLA)由安进公司递交,并被CDE纳入优先审评。倍利妥由安进公司开发,百济神州根据今年早先达成的全球肿瘤战略合作获得其在中国的授权。该上市申请获批是倍利妥?在中国的首项获批,也是百济
全球首个针对HAE的单克隆抗体(mAb)药物达泽优®(拉那利尤单抗注射液)获批进入中国,为遗传性血管性水肿患者带来治疗新突破
武田中国宣布,旗下创新药物达泽优®(拉那利尤单抗注射液)经国家药品监督管理局批准,适用于12岁及以上患者预防遗传性血管性水肿(HAE)的发作。达泽优®(拉那利尤单抗注射液)是目前全球唯一一款针对遗传性血管性水肿的单克隆抗体(mAb)药物,可降低患者的水肿反复发作次数,预防致命性喉头水肿所导致的窒息,改善患者及其家
荣昌生物治疗胃癌ADC新药维迪西妥单抗获美国FDAⅡ期临床试验许可及快速通道资格
荣昌生物治疗胃癌ADC新药维迪西妥单抗获美国FDAⅡ期临床试验许可及快速通道资格近日,由荣昌生物制药(烟台)股份有限公司自主研发的ADC新药注射用维迪西妥单抗(商品名:爱地希®)获得美国食品和药物管理局(FDA)针对晚期或转移性胃癌以及胃食管结合部腺癌的Ⅱ期临床试验许可(IND),并获FDA针对胃癌适应症的快速通道资格(Fast Track Designat
嘉和生物提交英夫利昔单抗生物类似药上市申请
10月27日,嘉和生物宣布已向中国国家药品监督管理局(NMPA)提交英夫利昔单抗生物类似药GB242的上市申请,这也是继PD-1抗体杰诺单抗后嘉和生物提交的第二个上市申请。查询NMPA官网信息,除了强生(Johnson & Johnson)公司的原研药类克(英夫利西单抗)外,目前中国尚无英夫利西单抗生物类似药获批上市。英夫利西单抗是一种抗
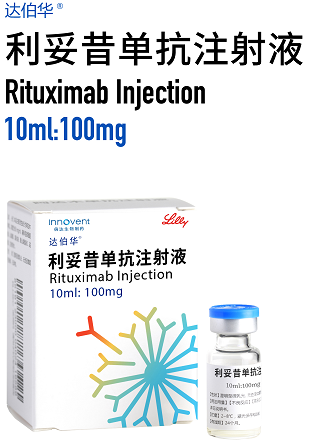
达伯华®(利妥昔单抗注射液)在中国正式获批上市
礼来制药(纽约证券交易所代码:LLY)和信达生物制药(香港联交所股票代码:01801)共同宣布,双方共同开发的重组人-鼠嵌合抗CD20单克隆抗体注射液达伯华®(利妥昔单抗注射液,英文商标: HALPRYZA®)正式获得国家药品监督管理局(NMPA)的上市批准,用于治疗弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤及慢性淋巴细胞性白血病。这是继达