治疗特定肺癌免疫疗法Keytruda获优先审评
默沙东(MSD)公司宣布美国FDA已经接受其重磅免疫疗法Keytruda(pembrolizumab)的补充生物制剂许可申请(sBLA)。该申请有望让Keytruda与卡铂-紫杉醇(carboplatin-paclitaxel)或白蛋白结合型紫杉醇(nab-paclitaxel)联合使用,作为转移性鳞状非小细胞肺癌(NSCLC)的一线疗法,而不用考虑PD-L1的表达水平。FDA同时授予该sBLA优
研究发现水稻黄单胞菌效应子调控作物免疫新机制
黄单胞菌是一类能够侵染水稻、小麦、番茄以及十字花科等多种单子叶和双子叶植物的病原细菌。水稻黄单胞菌侵染水稻造成的白叶枯病是水稻最主要的细菌性病害之一,给农业生产带来了巨大的损失。病原细菌通过三型分泌系统分泌许多效应子进入植物细胞内,操控植物细胞内的免疫信号传导以及其他多种细胞生物学过程(如干扰植物蛋白功能、操纵植物激素改变等),来帮助病原微生物致病。水稻白叶枯病菌的三型分泌系统效应子包括两大类:转
辉瑞SMO抑制剂Glasdegib获得FDA优先审评认定
6月27日,辉瑞公司宣布,美国FDA接受了该公司口服smoothened (SMO)抑制剂Glasdegib与低剂量阿糖胞苷(LDAC)联用治疗未经治疗的成人急性髓系白血病(AML)的新药申请,并给予其优先审评认定。FDA决定的处方药使用者费用法案(PDUFA)目标日期在2018年12月。辉瑞全球产品开发肿瘤学首席开发官Mace Rothenberg博士表示:“急性髓系白血病患者若不能接受强化化疗
美国FDA授予默沙东免疫疗法Keytruda优先审查资格
2018年7月3日讯 /生物谷BIOON/ --肿瘤免疫治疗巨头默沙东(Merck & Co)近日宣布,美国食品和药物管理局(FDA)已受理PD-1免疫疗法Keytruda(pembrolizumab)的一份补充生物制品许可(sBLA)并授予了优先审查资格,其处方药用户收费法(PDUFA)目标日期为2018年10月30日。该sBLA旨在申请加速批准Keytruda联合化疗(卡铂与紫杉醇或白
辉瑞glasdegib被美国FDA授予优先审查,一线治疗急性髓性白血病(AML)
2018年6月27日讯 /生物谷BIOON/ --制药巨头辉瑞(Pfizer)近日宣布,美国FDA已受理靶向药物glasdegib的新药申请(NDA)并授予了优先审查资格,其处方药用户收费法(PDUFA)目标日期为2018年12月。该药是一种实验性口服Smoothened蛋白(SMO)抑制剂,目前正被评估联合低剂量阿糖胞苷(LDAC)化疗,用于既往未接受治疗的(初治)急性髓性白血病(AML)成人患
Themis公司基孔肯雅病毒疫苗产品获欧盟EMA优先药物资格(PRIME)
2018年6月12日讯 /生物谷BIOON/ --奥地利生物技术公司Themis Bioscience近日宣布,欧洲药品管理局(EMA)已授予基孔肯雅病毒(chikungunya virus,CHIKV)疫苗项目优先药物资格(Priority Medicines,PRIME),该疫苗用于预防基孔肯雅热。PRIME是EMA在2016年3月推出的一个重点药品快速审评程序,与美国FDA的突破性疗法认定(
健康元2个产品拟纳入优先审评程序
国家食品药品监督管理局药品审评中心近日发布《拟纳入优先审评程序药品注册申请的公示(第二十九批)》,将拟优先审评的药品注册及其申请人予以公示,公示期 5 日(详见:新一批优先审评名单公布 6个儿童药、罕见病药在列)。6月7日公告显示,健康元药业集团股份有限公司(简称“健康元”)全资子公司深圳太太药业有限公司(太太药业)与控股子公司上海方予健康医药科技有限公司(方予健康)申报的盐酸左旋沙丁
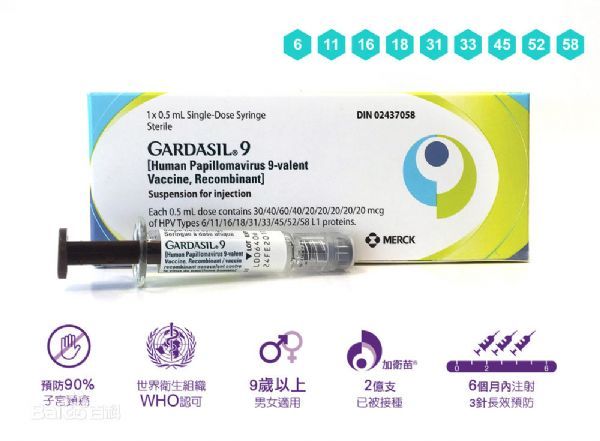
默沙东HPV疫苗Gardasil 9(加卫苗,9价)获美国FDA优先审查
2018年6月14日讯 /生物谷BIOON/ --美国制药巨头默沙东(Merck & Co)近日宣布,美国食品和药物管理局(FDA)已受理Gardasil 9(加卫苗,9价重组人乳头状瘤病毒疫苗)的一份补充生物制品许可(sBLA)并授予了优先审查资格,其处方药用户收费法(PDUFA)日期为2018年10月6日。该sBLA旨在寻求批准扩大Gardasil 9的年龄适应症,用于27-45岁的男
辉瑞talazoparib治疗乳腺癌斩获美国FDA优先审查资格
2018年6月8日讯 /生物谷BIOON/ --制药巨头辉瑞(Pfizer)近日宣布,美国食品和药物管理局(FDA)已受理靶向抗癌药talazoparib的新药申请(NDA)并授予了优先审查资格,其处方药用户收费法(PDUFA)目标日期为2018年12月。此次NDA寻求批准该药用于种系(遗传获得)BRCA突变(gBRCAm)、HER2阴性局部晚期或转移性乳腺癌(MBC)患者的治疗。欧盟方面,欧洲药
罗氏Hemlibra获得无VIII因子抑制物A型血友病治疗优先审评认定
6月5日,罗氏制药公布称美国FDA已经接受了Hemlibra? (emicizumab-kxwh)用于未产生VIII因子抑制物A型血友病成人及儿童患者治疗的补充新药申请(sBLA),并授予其优先审评。sBLA是基于临床三期HAVEN 3的数据制定的。预计FDA将在2018年10月4日前作出批准决定。罗氏首席医学官及全球产品开发负责人Sandra Horning博士表示:“A