辉瑞/BioNTech 疫苗获FDA批准可在正常冷冻温度下保存2周
美国食品药物管理局(FDA)宣布,批准辉瑞/BioNTech mRNA疫苗(商品名:Comirnaty )在常规药品冷冻箱温度下(-25℃至-15℃)运输和储存2周时间。以作为在超低温(-80℃至-60℃)冰箱中储存的替代或补充。Comirnaty 是基于BioNTech专有mRNA技术,由辉瑞和BioNTech 共同开发
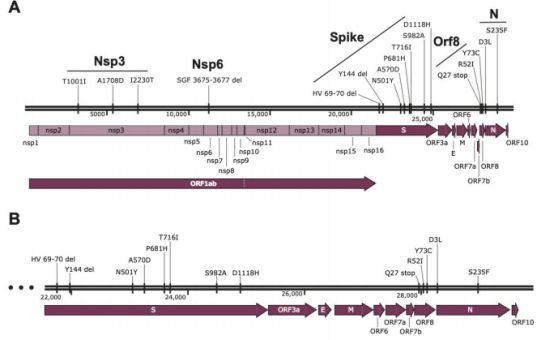
Science:新研究表明BioNTech-Pfizer新冠疫苗基本上仍可有效中和英国突变株B.1.1.7
2021年1月31日讯/生物谷BIOON/---在一项新的评估BioNTech-Pfizer COVID-19疫苗中和新型冠状病毒SARS-CoV-2英国突变株B.1.1.7(之前称为VOC 202012/01)的能力的研究中,来自德国BioNTech公司和美国辉瑞公司(Pfizer)的研究人员发现,与在武汉发现的SARS-CoV-2参考毒株相比,该疫苗没有
辉瑞 BioNTech联合研制的新冠疫苗获FDA紧急使用授权
美国食品药品监督管理局(FDA)批准由美国制药公司辉瑞(Pfizer)和德国BioNTech公司联合开发的新冠疫苗的紧急使用授权(EUA)申请。根据FDA发布的消息,FDA已确定Pfizer-BioNTech COVID-19疫苗已符合签发EUA的法定标准。可用数据的总数提供了明确的证据,证明辉瑞-BioNTech联合开发的COVID
英国正式批准辉瑞/BioNTech新冠疫苗上市!
#英国正式批准辉瑞/BioNTech新冠疫苗上市!东时间12月02日02时05分(北京时间15时05分),辉瑞(NYSE: PFE) 和BioNTech(Nasdaq: BNTX) 今天宣布,英国药品和医疗产品监管署(MHRA)已批准其新冠肺炎mRNA疫苗BNT162b2的紧急使用授权,各方已准备好立即向英国提供第一批辉瑞疫苗。辉瑞称英国
辉瑞/BioNTech新冠疫苗本周可能会获得英国的批准
辉瑞和BioNTech开发的新冠疫苗可能最早将在本周末获得英国监管机构的批准。临床医生已被告知12月1日要做好迎接疫苗的准备。据英国媒体报道,政府消息人士对《每日电讯报》表示,在“最佳情况”下,一周之内英国药监部门可能会做出决定,而英国国民保健系统(NHS)可能会准备在12月1日前开始分发疫苗。这将意味着辉瑞/BioNTech疫苗将在美国之前获得
辉瑞/BioNTech计划扩展新冠疫苗关键性临床试验
辉瑞(Pfizer)公司和BioNTech日前宣布,已经向美国FDA提交了一份修正方案,计划将其候选新冠疫苗BNT162b2的关键性3期临床试验的招募人数从3万名增加到高达4.4万名,同时这一修正方案将允许招募新的参与者人群。辉瑞和BioNTech联合进行的BNT162研发项目最初包括4种不同的mRNA疫苗。进入2/3期临床研究的BNT162b2是一款编码新
辉瑞/BioNTech新冠疫苗更多阳性数据公布
上个月,BioNTech和辉瑞发布了共同开发的mRNA新冠候选疫苗BNT1621b1德国I/II期试验的积极数据,并表示已与美国政府就BNT162达成19.5亿美元协议。(相关阅读:19.5亿美元!辉瑞/BioNTech新冠疫苗获得美国政府大订单)近日,两家公司又公布了BNT162 mRNA基础疫苗项目中一项1期临床研究的安全性和免疫原性数据。结
中国复星医药和德国BioNTech宣布已在中国开始基于mRNA的新冠疫苗的临床试验工作
2020年8月6日 讯 /生物谷BIOON/ --8月5日,中国上海复星医药股份有限公司和德国BioNTech公司宣布,他们已经在中国开展了一种潜在的冠状病毒疫苗相关的人体临床试验。两家公司在一份声明中表示,在中国监管部门批准进行第一阶段的试验后,已经有72名参与者接受了第一剂疫苗的注射。这种候选疫苗名为BNT162b1,其是基于BioNTech公司mRNA