Nucleic Acids Res:利用I-F型CRISPR-Cas系统高效编辑超级细菌
来源:本站原创 2021-08-29 19:30
Yan团队将整个I-F型cas 操纵子克隆到精通整合的载体mini-CTX中,并通过接合将它递送到异源宿主。mini-CTX载体能够将整个Cascade整合到异源宿主基因组中保守的attB基因座上,使它们能够容纳一种能够稳定表达和发挥作用的天然I-F型CRISPR-Cas系统。
2021年8月29日讯/生物谷BIOON/---在一项新的研究中,来自中国香港大学的研究人员开发出一种可转移的整合的基于I型CRISPR的平台,它可以有效地编辑铜绿假单胞菌的不同临床分离株,其中铜绿假单胞菌是能够感染多种组织和器官的超级细菌,是院内感染的主要来源。该技术可以加速识别多药耐药(MDR)病原体的耐药性决定因素,并开发新的抗耐药性策略。相关研究结果近期发表在Nucleic Acids Research期刊上,论文标题为“A transferrable and integrative type I-F Cascade for heterologous genome editing and transcription modulation”。论文通讯作者为香港大学理学院分子与细胞生物学研究部副教授Aixin Yan博士。

这项研究为对那些野生细菌物种和分离株进行基因组编辑开辟了一条新的途径,比如那些具有临床和环境意义的细菌以及形成人类微生物组的细菌。它还提供了一个框架,以利用原核生物基因组中广泛存在的其他CRISPR-Cas系统,并扩大基于CRISPR的工具包。
研究背景
CRISPR-Cas系统包括原核生物的适应性免疫系统,该适应性免疫系统通过切割病毒的DNA来清除入侵的病毒。由于CRISPR-Cas具有靶向和改变DNA序列的独特能力,它已被作为下一代基因组编辑方法加以利用。该方法基于已彻底改变了许多生物的遗传学和生物医学研究的第二类II型CRISPR/Cas9系统。然而,第二类CRISPR-Cas系统只占原核生物中自然编码的CRISPR-Cas系统的10%左右。它们在编辑细菌基因组方面的应用相当有限。
值得注意的是,属于不同类别和类型的CRISPR-Cas系统不断被发现,它们是扩展基于CRISPR的工具包的一个深层文库。最多样化和分布最广的CRISPR-Cas系统是I型系统,它占所有已发现的CRISPR-Cas系统的50%,并有可能扩大基于CRISPR的工具包,具有第二类CRISPR/Cas系统无法获得的独特优势,如高特异性,最小的脱靶,并能进行大片段序列的缺失。然而,I型CRISPR-Cas系统依赖于一种称为Cascade的多组分效应复合物来干扰DNA,这不容易转移到异源宿主,阻碍了这些天然丰富的CRISPR/Cas系统在基因组编辑和治疗方面的广泛运用。
关键发现
此前,Yan博士及其团队在临床多药耐药的铜绿假单胞菌菌株PA154197中发现了一种高度活跃的I-F型CRISPR-Cas系统,其中该菌株是从香港玛丽医院的一个血流感染病例中分离出来的。他们对这一CRISPR-Cas系统进行了表征,并在这种天然的I-F型CRISPR-Cas系统的基础上成功开发了适用于这种MDR分离株的基因组编辑方法。该方法使快速鉴定MDR临床分离株的耐药性决定因素和开发新的抗耐药性策略成为可能(Cell Reports, 2019, 29, 1707-1717)。
为了克服将这种复杂的I型Cascade转移到异源宿主的障碍,在这项研究中,Yan团队将整个I-F型cas 操纵子克隆到精通整合的载体mini-CTX中,并通过接合(一种自然界中常见的DNA转移方法)将它递送到异源宿主。mini-CTX载体能够将整个Cascade整合到异源宿主基因组中保守的attB基因座上,使它们能够容纳一种能够稳定表达和发挥作用的天然I-F型CRISPR-Cas系统。他们发现,与可转移的CRISPR/Cas9系统相比,转移的I-F型Cascade显示出明显更强的DNA干扰能力和更高的菌株稳定性,并可被用于基因组编辑,效率高(>80%)且简单,即通过一步转化单一编辑质粒即可实现。
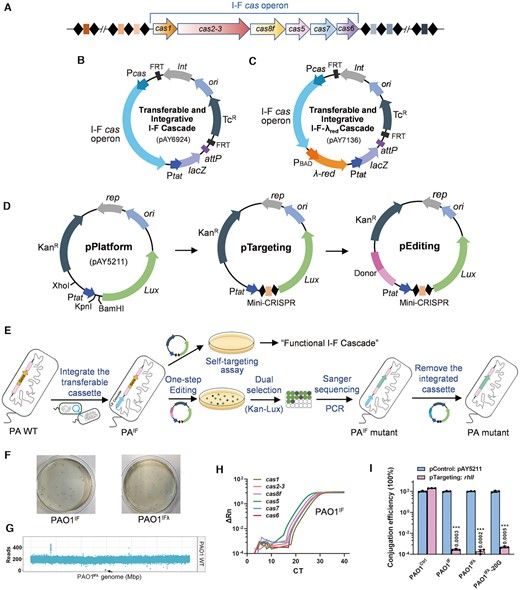
可转移的整合的基于I-F型Cascade的基因组编辑概述,图片来自Nucleic Acids Research, 2021, doi:10.1093/nar/gkab521。
此外,他们还开发了一种先进的可转移系统,包括高活性的I-F型Cascade和重组酶,以促进该系统在同源重组能力差的菌株、没有基因组序列信息的野生铜绿假单胞菌分离株和其他假单胞菌种中的应用。最后,通过I-F Cascade介导的大DNA片段的缺失,引入的I-F Cascade基因可以很容易地从宿主基因组中移除,从而在宿主细胞中实现无痕基因组编辑。他们还展示了这种可转移系统在基因抑制方面的应用,突出了这种所开发的可转移I-F型CRISPR系统的强大和多样化应用。
Yan博士预测,这种新方法不仅可以扩展到对病原体进行编辑,还可以扩展到对微生物组进行编辑,以促进人类健康。她说,“我们相信,这种基于CRISPR的技术和疗法将为未来对抗超级细菌带来新的希望。”(生物谷 Bioon.com)
参考资料:
Zeling Xu et al. A transferrable and integrative type I-F Cascade for heterologous genome editing and transcription modulation. Nucleic Acids Research, 2021, doi:10.1093/nar/gkab521.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


