Cell:重大进展!实验性药物CA激活分子伴侣介导的自噬,有潜力治疗阿尔茨海默病
来源:本站原创 2021-04-24 20:19
2021年4月24日讯/生物谷BIOON/---在一项新的研究中,来自美国阿尔伯特-爱因斯坦医学院的研究人员设计出一种实验性药物,它可以在小鼠体内逆转阿尔茨海默病的关键症状。该药物通过重新激活一种消化和循环利用不需要的蛋白以去除它们的细胞清理机制而起作用。相关研究结果于2021年4月22日在线发表在Cell期刊上,论文标题为“Chaperone-mediat
2021年4月24日讯/生物谷BIOON/--- 阿尔茨海默病是一种起病隐袭、呈进行性发展的神经退行性疾病,临床特征主要为认知障碍、精神行为异常和社会生活功能减退。一般在65 岁以前发病为早发型,65 岁以后发病为晚发型,有家族发病倾向被称为家族性阿尔茨海默病,无家族发病倾向被称为散发性阿尔茨海默病。
据世界卫生组织报告,目前全球约有5000 万人患有痴呆症,其中阿尔茨海默病是最常见的类型。阿尔茨海默病可能的危险因素包括:增龄、女性、低教育水平、吸烟、中年高血压与肥胖、听力损害、脑外伤、缺乏锻炼、社交孤独、糖尿病及抑郁障碍等。
在一项新的研究中,来自美国阿尔伯特-爱因斯坦医学院的研究人员设计出一种实验性药物,它可以在小鼠体内逆转阿尔茨海默病的关键症状。该药物通过重新激活一种消化和循环利用不需要的蛋白以去除它们的细胞清理机制而起作用。相关研究结果于2021年4月22日在线发表在Cell期刊上,论文标题为“Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome”。

这些作者表示,在小鼠身上取得的发现并不总是适用于人类,特别是在阿尔茨海默病中,不过他们发现导致阿尔茨海默病小鼠模型的细胞清理能力下降也发生在该疾病患者身上,这表明这种药物也可能在人类身上发挥作用。在20世纪90年代,阿尔伯特-爱因斯坦医学院老龄化研究所共同主任Ana Maria Cuervo博士发现了这种称为分子伴侣介导的自噬(chaperone-mediated autophagy, CMA)的细胞清理过程,至今针对它在健康和疾病中的作用发表了200篇论文。
随着人们年龄的增长,CMA的效率越来越低,这就增加了不需要的蛋白积累成损害细胞的不溶性团块的风险。事实上,阿尔茨海默病和所有其他神经退行性疾病的特点是在患者的大脑中存在有毒的蛋白聚集物。这些作者在这项研究中揭示了CMA和阿尔茨海默病之间的动态相互作用,神经元中CMA的丧失可促进阿尔茨海默病,反之亦然。这些发现表明,激活CMA的药物可能为治疗神经退行性疾病带来希望。
这些作者首先研究了CMA受损是否会导致阿尔茨海默病。为此,他们对小鼠进行了基因改造,使之具有缺乏CMA的兴奋性大脑神经元。这种脑细胞中的CMA缺失足以导致短期记忆丧失、行走障碍,以及在阿尔茨海默病的啮齿类动物模型中经常发现的其他问题。此外,CMA的缺失极大地破坏了蛋白稳态(proteostasis)---细胞调节它们所含蛋白的能力。正常情况下可溶性的蛋白已经转变为不可溶性,并有风险形成有毒的聚集物。
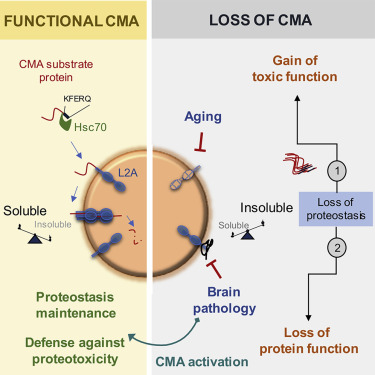
激活CMA可维持蛋白稳态和抵抗蛋白毒性,图片来自Cell, 2021, doi:10.1016/j.cell.2021.03.048。
这些作者猜测反过来也是如此:早期阿尔茨海默病会损害CMA。因此,他们研究了早期阿尔茨海默病的小鼠模型,在该模型中,大脑神经元经改造后产生缺陷的tau蛋白版本。有证据表明,tau蛋白的异常版本会聚集在一起,形成神经纤维缠结,从而导致阿尔茨海默病。他们重点关注海马体神经元中的CMA活动,其中海马体是对记忆和学习至关重要的大脑区域。他们发现,与对照组小鼠相比,在这种小鼠模型中,这些神经元中的CMA活动明显减少。
人类的早期阿尔茨海默病是否也会阻断CMA?为了找到答案,这些作者查看了从阿尔茨海默病患者和健康人的死后大脑中获得的神经元的单细胞RNA测序数据。这些测序数据显示了患者脑组织中CMA的活动水平。果然,在阿尔茨海默病的早期阶段,CMA的活动受到一定程度的抑制,随后在阿尔茨海默病晚期患者的大脑中,CMA受到的抑制要大得多。
当人们达到70或80岁时,CMA的活动通常比他们年轻时减少了约30%。大多数人的大脑可以补偿这种下降。但是,如果再加上神经退行性疾病,对大脑神经元的正常蛋白构成的影响可能是毁灭性的。这些作者发现CMA的缺乏与阿尔茨海默病的病理发生协同作用,从而极大地加速了疾病进展。
在其中的一项令人鼓舞的发现中,这些作者开发了一种新型药物,它显示出治疗阿尔茨海默病的潜力。他们知道CMA能够降解有缺陷的tau和其他蛋白,但是阿尔茨海默病和其他神经退行性疾病中大量的缺陷蛋白使CMA不堪重负,基本上使其瘫痪。这种药物通过提高一种关键的CMA成分的水平来重新提升CMA的效率。
在CMA中,称为分子伴侣的蛋白与体内细胞中受损或有缺陷的蛋白结合。分子伴侣将它们的货物运送到细胞的溶酶体。溶酶体是一种有膜细胞器,它含有的酶消化和循环利用废弃物。然而,为了成功地将它们携带的货物送入溶酶体,分子伴侣必须首先将货物“对接”到一种名为LAMP2A的蛋白受体上,该受体从溶酶体的膜上长出。溶酶体上的LAMP2A受体越多,潜在的CMA活动水平就越高。这种名为CA的新型药物通过增加这些LAMP2A受体的数量而发挥作用。
这些作者表示,人们在一生中产生相同数量的LAMP2A受体,不过,这些受体随着年龄的增加而退化得更快,因此老年人往往有较少的受体用于将不需要的蛋白递送到溶酶体。CA将LAMP2A恢复到年轻时的水平,使得CMA能够清除缺陷的tau和其他有缺陷的蛋白,这样它们就不能形成有毒的蛋白团块。[这些作者在本月在Nature Communications期刊上首次报道,他们从阿尔茨海默病患者的大脑中分离出溶酶体,并观察到LAMP2受体数量的减少导致人类的CMA丧失,就像在阿尔茨海默病的动物模型中观察到的那样(Nature Communications, 2021, doi:10.1038/s41467-021-22501-9)。]
这些作者在两种不同的阿尔茨海默病小鼠模型中测试了CA。在这两种小鼠模型中,在4到6个月的时间里给送口服剂量的CA可以改善记忆、抑郁和焦虑,使接受治疗的小鼠模型看起来像或非常像健康的对照小鼠。在走路能力上有问题的小鼠模型中,这种走路能力得到明显改善。而且在两种小鼠模型的大脑神经元中,与未经治疗的小鼠相比,该药物明显降低了tau蛋白和蛋白团块的水平。
重要的是,这两种小鼠模型都已经出现了疾病症状,它们的神经元在用药之前就已经被有毒的蛋白堵塞了。这意味着该药物可能有助于保护神经元的功能,即便在这种疾病的后期阶段。这些作者还感到非常兴奋的是,该药物显著减少了胶质增生(gliosis),即大脑神经元周围细胞的炎症和瘢痕形成。胶质增生与有毒的蛋白有关,并且已知在延续和恶化神经退行性疾病方面起着重要作用。
用CA治疗似乎并不损害其他器官,即使在较长长时间内每天给药也是如此。这些作者目前正在开发CA及其相关化合物,用于治疗阿尔茨海默病和其他神经退行性疾病。(生物谷 Bioon.com)
参考资料:
Mathieu Bourdenx et al. Chaperone-mediated autophagy prevents collapse of the neuronal metastable proteome. Cell, 2021, doi:10.1016/j.cell.2021.03.048.
Benjamin Caballero et al. Acetylated tau inhibits chaperone-mediated autophagy and promotes tau pathology propagation in mice. Nature Communications, 2021, doi:10.1038/s41467-021-22501-9.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


