Nature子刊:用无病毒睡美人基因转移制备的SLAMF7 CAR-T细胞治疗多发性骨髓瘤的人体临床试验
来源:本站原创 2021-04-22 16:53
2021年4月22日讯/生物谷BIOON/---基于经过基因改造的嵌合抗原受体(CAR)T细胞(CAR-T)的过继性免疫疗法在细胞疗法和基因疗法领域取得重大突破和成功。靶向CD19抗原的CAR-T细胞疗法已被批准用于治疗急性淋巴细胞白血病(ALL)、非霍奇金淋巴瘤(NHL)和套细胞淋巴瘤,而且靶向几种其他抗原的CAR-T细胞产品正在血液学和肿瘤学领域进行研究
2021年4月22日讯/生物谷BIOON/---基于经过基因改造的嵌合抗原受体(CAR)T细胞(CAR-T)的过继性免疫疗法在细胞疗法和基因疗法领域取得重大突破和成功。靶向CD19抗原的CAR-T细胞疗法已被批准用于治疗急性淋巴细胞白血病(ALL)、非霍奇金淋巴瘤(NHL)和套细胞淋巴瘤,而且靶向其他抗原的CAR-T细胞产品正在血液学和肿瘤学领域进行研究。
目前有三种CD19 CAR-T细胞产品,即Kymriah™(基于慢病毒载体)、Yescarta™(基于γ-逆转录病毒载体)和Tecartus™(基于γ-逆转录病毒载体),已获得美国食品药品管理局(FDA)和欧洲药品管理局(EMA)的上市授权。所有这三种产品都是自体的、经过基因改造的CAR-T细胞:从患者身上获取的T细胞在体外接受基因改造,然后再重新给送到相同的患者体内(图1)。目前的体外自体CAR-T细胞治疗模式包括一个劳动、时间和成本密集型的供应链,即在白细胞分离中心(leukapheresis center)采集患者的T细胞,将它们运输到集中式生产设施进行CAR基因转移和T细胞扩增,然后将冷冻保存的CAR-T细胞产品运回医院,在医院将CAR-T细胞给送到患者体内(图1)。
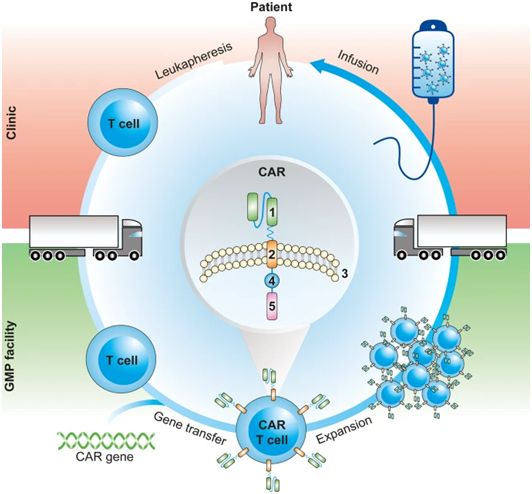
图1.CAR-T细胞制造管道,图片来自Gene Therapy, 2021, doi:10.1038/s41434-021-00254-w。
人们对促进CAR-T细胞疗法的制造和供应有着强烈的兴趣和需求,以确保这种疗法确实可以整合并成为临床实践的“常规”,并确保患者能够适当平等地接受这种治疗。科学家们认为,无病毒基因转移技术是一种关键手段,可以通过以精简的具有成本效益的方式制造经过基因改造的治疗性细胞来确定CAR-T细胞产品的可持续市场价格。因此,德国研究人员在一篇新的论文中,专注于将无病毒睡美人(Sleeping Beauty, SB)基因转移应用于CAR-T细胞工程。CARAMBA项目开创了这种前沿的技术在首次人体临床试验中的应用。

CARAMBA项目:将前沿CAR-T细胞技术应用于临床
CARAMBA项目的核心目标是在多发性骨髓瘤患者中进行首个通过无病毒SB基因转移技术制备的SLAMF7特异性CAR-T细胞的人体临床试验。CARAMBA联盟包括来自六个欧盟国家的十个合作伙伴。其中包括四个卓越的骨髓瘤临床护理和研究领域的临床中心:维尔茨堡大学医院(德国)、圣拉斐尔科学研究医院(意大利)、纳瓦拉大学(西班牙)和里尔大学地区医院中心(法国)。其他项目合作伙伴包括患者组织“欧洲骨髓瘤患者(Myeloma Patients Europe)”、良好生产规范(GMP)制造商BSD-BRK(德国)、保罗埃利赫研究院-联邦疫苗与生物医学研究所(德国)、位于瑞士的生物技术公司NBE-Therapeutics和位于德国的T-CURX,以及法国项目管理供应商ARTTIC公司。欧盟委员会在地平线2020研究和创新计划(Horizon 2020 Research and Innovation program)中呼吁对“罕见疾病进行创新治疗(Innovative treatments for rare diseases)”,从大量具有高度竞争性的项目提案中选择了CARAMBA项目。CARAMBA项目于2018年1月启动,项目期限为52个月。
CARAMBA项目中的关键技术:利用SB转座子系统进行无病毒基因转移
DNA转座子是具有改变其在基因组内位置能力的遗传元件。在自然界中,这些遗传元件作为移动(“跳跃”)的DNA单元存在,包含一个转座酶基因,其两侧是带有转座酶结合位点的末端反向重复序列(TIR)。重要的是,可以将转座子的两个功能成分(TIR和转座酶)以双组分载体系统的形式分开。基于转座子的载体可以在转座子的两个TIR之间加入几乎任何感兴趣的DNA序列,并通过反式补充转座酶来动员(图2)。在转座过程中,转座酶介导遗传元件从供体载体上切除,然后将转座子整合到一个染色体位点(图2)。这一特点使得转座子成为能够进行有效基因组整合的非病毒基因递送系统,可作为工具用于基因工程的各种应用,包括基因治疗。
基于从鱼类基因组中分离出来的古老的非活性转座子序列,科学家们重建了一个活性转座子,并以格林兄弟的著名童话故事,将它命名为SB。SB是有史以来第一个被证明能够在脊椎动物细胞中有效转座的转座子,从而为包括基因治疗在内的基因工程提供了新的途径。基于SB转座子的基因递送的优点是它结合了病毒载体和裸DNA分子的有利特征,即:(i)转基因盒(transgene cassette)的永久性基因组插入可导致持续和高效的转基因表达;(ii)与需要在体内重复给送而引起针对载体编码蛋白的免疫反应的非整合性病毒载体相反,SB载体只需要一次给送,从而降低体内的免疫原性;(iii) 与腺相关病毒(AAV)载体和逆转录病毒载体相比,SB载体在携带的基因货物的大小方面没有严格的限制;(iv) 优越的生物安全性;(v)与病毒载体相比,转座子载体可以作为质粒DNA进行维持和扩增,这使得它们的制造简单而便宜,这是在临床实践中实施和扩大规模的一个重要考虑。
利用SB转座子系统进行治疗性基因递送
基于SB转座子的非病毒基因递送具有出色的潜力,为一系列单基因疾病提供创新和潜在的治疗。SB于2011年成功进入临床阶段,作为第一个产生用于辅助性免疫治疗的CD19特异性CAR-T细胞的非病毒载体进行了两项临床试验:在自体造血干细胞移植后,利用所产生的CAR-T细胞靶向非霍奇金淋巴瘤(NHL)和急性淋巴细胞白血病(ALL)患者(n=7)中微小残留病(临床试验编号:NCT00968760);在异体造血干细胞移植后,利用所产生的CAR-T细胞靶向非霍奇金淋巴瘤(NHL)和急性淋巴细胞白血病(ALL)患者(n=19)中微小残留病(临床试验编号:NCT01497184)。在自体造血干细胞移植后,30个月的无进展存活率和总存活率分别为83%和100%。在异体造血干细胞移植后,12个月的无进展存活率和总存活率分别为53%和63%。没有观察到急性或晚期毒性反应,也没有观察到移植物抗宿主疾病(GvHD)的恶化(在异体造血干细胞移植的情形下)。
这些初步研究确定了安全性,并说明了在CAR-T基因工程中使用SB的潜力。此外,最近有报道称,在一项I/II期临床试验(NCT03389035)中,异体、供体来源的CD19 CAR细胞因子诱导的杀伤细胞(cytokine induced killer cell, CIK)在复发性和难治性ALL患者中表现出高扩增、低毒性和完全缓解。CIK细胞显示出诱人的安全性,在异体细胞移植后很少出现GvHD,因此,这些结果表明在异体造血干细胞移植后,用SB转座子设计的供体来源细胞是安全和有效的治疗选择,即使是不匹配的供体造血干细胞移植。目前共有14项利用SB基因转移技术进行的基因治疗临床试验,还有一些临床试验正在计划中。
将SB转座子系统递送到细胞的典型方法是将这个载体系统的两个组成部分作为常规质粒提供(图2)。然而,使用裸质粒DNA与几个问题有关,阻碍了它在基因治疗中的实施。首先,通过电穿孔或其他DNA转染技术将质粒DNA递送到人原代细胞的效率通常很低。事实上,基于SB基因转移的CAR-T细胞初步临床应用依赖于使用提供转座子和转座酶的质粒载体,从而限制了稳定的基因转移水平,因此必须进行长时间的体外培养以获得治疗患者所需剂量的CAR-T细胞。其次,在不依赖于TLR4或TLR9刺激的人T细胞中,转移到细胞中的裸质粒DNA通过I型干扰素(IFN)反应诱导的剂量依赖性细胞毒性损害了细胞活力,这表明质粒DNA被先天免疫系统的细胞内DNA传感蛋白识别。最后,质粒载体中通常存在的抗生素抗性基因,在基因治疗方面引起了安全问题,因为有可能出现水平基因转移。SB载体技术的近期进展表明,通过使用微型环(minicircle, MC)载体来编码转座子和体外转录反应中合成的mRNA或重组蛋白来编码转座酶,可以解决SB基因递送的效率和安全性问题(图2)。
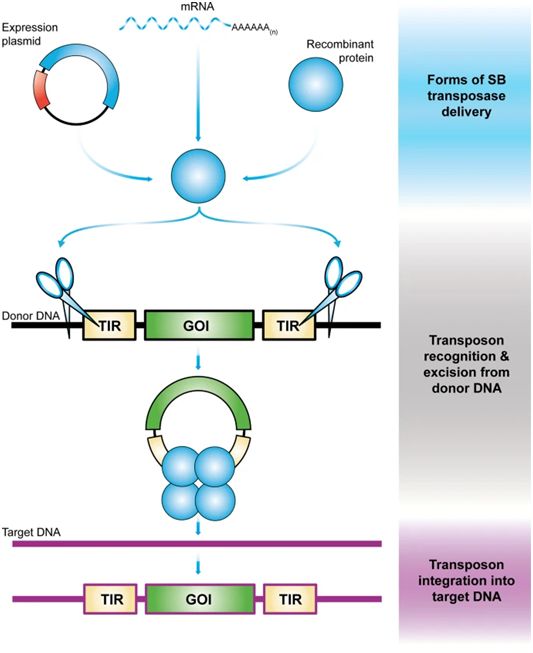
图2.利用睡美人转座子进行基因递送的示意图概述。图片来自Gene Therapy, 2021, doi:10.1038/s41434-021-00254-w。
MC是为应用于非病毒性基因递送而开发的极简化的超螺旋表达盒。它们是通过分子内重组过程从母体质粒中衍生出来的,在这个过程中,将大部分的细菌骨架序列从载体中剔除。因此,MC载体的大小明显减少。在基于SB转座子的基因递送方面,这些作者认为至少有三个与MC载体有关的优点。首先,就整体基因转移效率而言,MC优于质粒,因为由于其体积较小,它们比质粒更有效地穿过细胞膜和核膜。第二,基于MC的转座子载体中转座子TIR序列之间相对较短的大约200bp的距离可能有助于转座反应。第三,治疗性载体中细菌质粒骨架序列的缺乏在临床应用中是非常重要的,因为治疗性细胞产品中包含的抗生素抗性基因可能会引起安全问题。
使用体外转录的mRNA来编码转座酶为治疗性细胞工程提供了额外的优势。例如,相比于用质粒DNA核染,通过电穿孔将mRNA递送到原代人类细胞(包括造血干/祖细胞和T细胞)显示出明显减少的细胞毒性。这可能是由于mRNA不能在转染的T细胞中引起IFN反应。其次,mRNA绕过了转录的需要,因此在转染后,立即可用于细胞质中的蛋白翻译。最后,递送短暂编码SB转座酶的mRNA增加了这种方法的生物安全性,因为mRNA没有染色体整合的风险,从而减轻了由于转座酶的长期和不可控表达导致已整合的SB转座子不断重新活动而产生的基因组不稳定的潜在风险。
联合使用MC技术与合成mRNA技术最近已被证明可以在人类T细胞中实现极其稳定的基因转移效率,并且用于使用SB转座子载体的先进CAR-T细胞工程中。因此,CARAMBA联盟决定应用编码SB100X超活性转座酶的mRNA和携带配备有SLAMF7 CAR的SB转座子的MC载体的独特组合。
从实验到临床:SLAMF7 CAR-T细胞的GMP制造
与以前的治疗性基因转移相比,CARAMBA项目利用了两个最近的技术进步,解决了SB基因转移的有效性和安全性:体外转录的mRNA,用于编码先进的超活性SB100X转座酶;编码SLAMF7 CAR的MC载体。应用mRNA作为转座酶的来源,可以在SLAMF7 CAR-T细胞中实现转座酶的瞬时表达和快速丢失,这对于CARAMBA临床试验获得监管机构的批准至关重要。SLAMF7 CAR-T细胞中使用的CAR盒(图3A)是一种常规的第二代CAR,具有CD28衍生的共刺激结构域,并通过T2A序列共同表达截断的EGFR(tEGFR)盒。tEGFR被药用抗体西妥昔单抗(cetuximab)识别,有三个目的:(i) 在制造和配制过程中对CAR转导的细胞进行定量确定,(ii) 检测患者血液中的CAR转导细胞,以及(iii) 在出现严重毒性时用治疗剂量的西妥昔单抗剔除CAR-T细胞。CAR的靶向结构域来自于抗SLAMF7抗体elotuzumab,其安全性和耐受性先前已被证明。
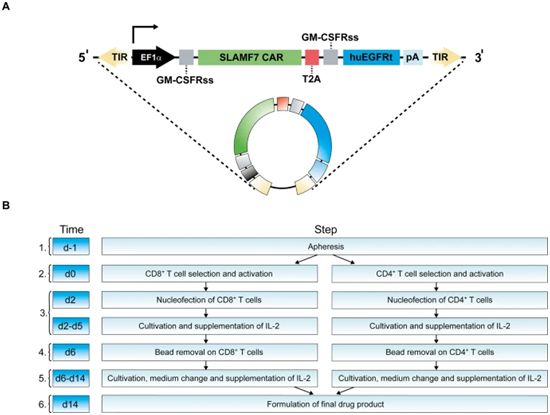
图3.CARAMBA CAR构建体及制造工艺示意图,图片来自Gene Therapy, 2021, doi:10.1038/s41434-021-00254-w。
CARAMBA细胞的制造(图3B)总共需要14天。在从患者体内分离出≥5×109个白细胞后,将获得的白细胞分为两部分,使得这两部分包含大约相同数量的CD4+T细胞和CD8+ T细胞。通过在一个开放系统中的研究级Miltenyi磁柱上,利用临床级抗体-微珠复合物和缓冲液进行免疫磁珠分选,使得这两批细胞富集CD4+T细胞或CD8+ T细胞。在T细胞经活化后,通过电穿孔将编码SB100X转座酶的mRNA和编码SLAMF7 CAR的MC载体转导到这些活化的T细胞中,然后将产生的SLAMF7 CAR-T细胞在体内进行扩增。
为了促进利用靶向SLAMF7抗原的自体T细胞在难治性多发性骨髓瘤患者中开展首次人体CARAMBA临床试验,这些作者基于临床前研究工作,建立了一个全新的生产流程。由此产生的工艺(图3)遵循德国和欧洲法律和指南规定的严格的GMP框架。CARAMBA的生产过程伴随着大量的过程中控制(in-process control, IPC)以降低风险,并有大量经过正式验证的质量控制测试(作为预先确定的质量规范以及“仅供参考”的辅助测试),以确定CARAMBA产品的制药质量。工艺开发遵循通常的顺序,即研究实验室的临床前工艺,识别和鉴定合适的起始材料和原材料,确定质量规范,开发必要的检测方法,包括正式的检测验证,工艺升级和工艺验证。在获得国家主管监管机构的方案审查和批准的同时,还获得了CARAMBA IMP的生产授权。
CARAMBA临床试验:SLAMF7 CAR-T细胞的首次人体应用
CARAMBA临床试验包括I期剂量递增部分和IIa期剂量扩大部分,将招募多达38名多发性骨髓瘤患者。CARAMBA临床试验将在德国、西班牙、法国和意大利的特定地点招募。为了参加CARAMBA临床试验,患者必须满足一些纳入和排除标准,例如患者之前至少接受过三种治疗方案,包括蛋白酶体抑制剂(如硼替佐米和卡非佐米)、免疫调节剂(如来那度胺或泊马度胺)、单克隆抗体(如达雷木单抗),而且大多数患者都接受过高剂量化疗,随后进行了自体造血干细胞移植,才有资格参加这项临床试验。此外,患者必须有可测量的骨髓瘤疾病标志物。以前接受过埃罗妥珠单抗(一种针对SLAMF7的单克隆抗体)治疗的患者,有资格参加CARAMBA临床试验。
由于CAR-T细胞疗法可能是一种强化的治疗方法,具有潜在的副作用,如细胞因子释放综合征(CRS)和神经毒性,因此还要求患者具有良好的表现状态,这种表现状态可用东部合作肿瘤组(Eastern Cooperative Oncology Group, ECOG)评分来衡量。患者的ECOG评分必须低于2分,意味着有较强的体能水平,才能参加这项临床试验。在确定CARAMBA临床试验的资格之前,患者必须有足够好的心脏、肝脏和肾脏功能,这些功能可由超声波和血液检查来评估。以前接受过异体造血干细胞移植的患者,如果这种移植在白细胞胞分离日期至少12个月前进行,那么就有资格参加CARAMBA临床试验。患有GvHD和服用药物抑制免疫系统的患者或有活动性感染(包括HIV、梅毒、乙肝和丙肝)的患者不符合参加CARAMBA临床试验的条件。CARAMBA临床试验的关键分析终点包括衡量使用SLAMF7 CAR-T细胞治疗骨髓瘤的可行性,由不良事件(如CRS和神经毒性)的数量和严重程度评估的安全性,以及抗骨髓瘤疗效。另外,在CARAMBA临床试验中,将对CAR-T细胞治疗背景下的生活质量和医院资源利用进行测量。
展望:CAR-T细胞治疗多发性骨髓瘤的证据
多发性骨髓瘤是一种罕见的由异常浆细胞导致的血液恶性肿瘤。多发性骨髓瘤的常规治疗包括化疗和蛋白酶体抑制剂等新型药物;然而,在过去十年中,体液免疫疗法和细胞免疫疗法正在改变对多发性骨髓瘤的治疗。CAR-T细胞疗法是多发性骨髓瘤治疗中最令人振奋的新发展,而且使用靶向B细胞成熟抗原(BCMA)的CAR-T细胞有了新的临床证据。一些BCMA CAR-T细胞产品目前正在临床开发中,并在对所有既定的抗多发性骨髓瘤治疗无反应(难治性)的复发患者中实现了非常高的反应率。总的来说,BCMA CAR-T细胞疗法显示了良好的安全性,CRS和神经毒性的发生率很低。然而,BCMA CAR-T细胞的临床经验也暴露了与靶向该抗原相关的一些挑战,疾病复发或治疗抵抗性的潜在机制包括抗原下调或甚至丧失。为应对这些挑战,目前正在寻求一些策略,包括使用γ-分泌酶抑制剂来提高多发性骨髓瘤细胞表面上的BCMA分子密度,减少血清中可溶性BCMA的数量,以及使用具有明确T细胞亚群组成和人源化靶向结构域的CAR来降低免疫原性,促进定植和体内扩增。
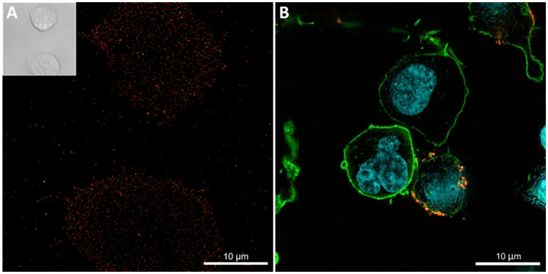
图4.表达SLAMF7的多发性骨髓瘤细胞,用CAR-T细胞靶向它们。图片来自Gene Therapy, 2021, doi:10.1038/s41434-021-00254-w。
此外,目前正在努力识别和验证多发性骨髓瘤中更多的CAR靶抗原,这些作者在CARAMBA临床试验中将重点评估SLAMF7作为一种新的候选抗原。一些研究已经证明了SLAMF7在恶性浆细胞表面上的高水平、均一性表达(图4A)。重要的是,SLAMF7的表达在复发/难治性的多发性骨髓瘤患者中以及在之前的强化治疗后仍然保留。在以前的研究工作中,这些作者已证明,在体外和体内的临床前模型中,表达SLAMF7 CAR的T细胞(图4B)对抗多发性骨髓瘤的效力大大高于抗SLAMF7抗体埃罗妥珠单抗,因此,他们热切期待CARAMBA临床试验的结果。(生物谷 Bioon.com)
参考资料:
Sabrina Prommersberger et al. CARAMBA: a first-in-human clinical trial with SLAMF7 CAR-T cells prepared by virus-free Sleeping Beauty gene transfer to treat multiple myeloma. Gene Therapy, 2021, doi:10.1038/s41434-021-00254-w.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


