Science:揭示核小体抑制cGAS激活的结构基础
来源:本站原创 2020-09-16 14:41
2020年9月16日讯/生物谷BIOON/---在所有哺乳动物中,环状GMP-AMP合酶(cGAS)感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在
2020年9月16日讯/生物谷BIOON/---在所有哺乳动物中,环状GMP-AMP合酶(cGAS)感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥之兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA。
cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是一旦cGAS检测到DNA存在于细胞核外面,它就突然起作用。它产生另一种化学物质---一种被称作cGAMP的第二种信使,从而引发一种分子链反应,结果就是提醒细胞中的DNA异常存在。在这种信号级联反应结束时,细胞要么得到修复,要么因损坏到无法修复的地步,它就会自我破坏。
但是细胞的健康和完整性取决于cGAS能够将无害的DNA和外来DNA或在细胞遭受损伤和应激期间释放出的自身DNA区分开来。
有人提出宿主DNA组装成核小体可限制cGAS的自动激活,但是它的基本机制尚不清楚。
在一项新的研究中,来自日本东京大学、早稻田大学和美国洛克菲勒大学的研究人员报告了这种抑制的结构基础。相关研究结果于2020年9月10日在线发表在Science期刊上,论文标题为“Structural basis for the inhibition of cGAS by nucleosomes”。
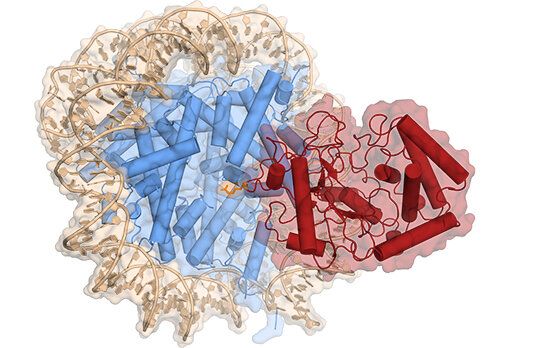
这些研究人员解析出人cGAS-核小体核心颗粒(cGAS-NCP)复合物的低温电镜(cryo-EM)结构。在这种结构中,两个cGAS单体通过结合H2A-H2B的酸性口袋(acidic patch)和核小体DNA来桥接两个核小体核心颗粒(NCP)。
在这种构型下,cGAS激活所需要的所有三个已知的cGAS DNA结合位点都被重新利用或无法进入,而且作为cGAS激活的另一个先决条件,cGAS二聚作用被抑制。让将cGAS和H2A-H2B的酸性口袋连接在一起的关键氨基酸残基发生突变可减轻核小体对cGAS激活的抑制。
总之,这项新的研究建立了一个结构框架,解释了为何cGAS在染色质的自我DNA上受到抑制。(生物谷 Bioon.com)
参考资料:
Tomoya Kujirai et al. Structural basis for the inhibition of cGAS by nucleosomes. Science, 2020, doi:10.1126/science.abd0237.
cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是一旦cGAS检测到DNA存在于细胞核外面,它就突然起作用。它产生另一种化学物质---一种被称作cGAMP的第二种信使,从而引发一种分子链反应,结果就是提醒细胞中的DNA异常存在。在这种信号级联反应结束时,细胞要么得到修复,要么因损坏到无法修复的地步,它就会自我破坏。
但是细胞的健康和完整性取决于cGAS能够将无害的DNA和外来DNA或在细胞遭受损伤和应激期间释放出的自身DNA区分开来。
有人提出宿主DNA组装成核小体可限制cGAS的自动激活,但是它的基本机制尚不清楚。
在一项新的研究中,来自日本东京大学、早稻田大学和美国洛克菲勒大学的研究人员报告了这种抑制的结构基础。相关研究结果于2020年9月10日在线发表在Science期刊上,论文标题为“Structural basis for the inhibition of cGAS by nucleosomes”。

cGAS(红色)与核小体组蛋白(蓝色)结合在一起时的低温电镜结构,图片来自Karl-Peter Hopfner。
这些研究人员解析出人cGAS-核小体核心颗粒(cGAS-NCP)复合物的低温电镜(cryo-EM)结构。在这种结构中,两个cGAS单体通过结合H2A-H2B的酸性口袋(acidic patch)和核小体DNA来桥接两个核小体核心颗粒(NCP)。
在这种构型下,cGAS激活所需要的所有三个已知的cGAS DNA结合位点都被重新利用或无法进入,而且作为cGAS激活的另一个先决条件,cGAS二聚作用被抑制。让将cGAS和H2A-H2B的酸性口袋连接在一起的关键氨基酸残基发生突变可减轻核小体对cGAS激活的抑制。
总之,这项新的研究建立了一个结构框架,解释了为何cGAS在染色质的自我DNA上受到抑制。(生物谷 Bioon.com)
参考资料:
Tomoya Kujirai et al. Structural basis for the inhibition of cGAS by nucleosomes. Science, 2020, doi:10.1126/science.abd0237.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


