Science论文深度解读!基因编辑大牛揭示碱基编辑器的作用机制
来源:本站原创 2020-07-31 15:49
2020年7月31日讯/生物谷BIOON/---在短短八年内,CRISPR-Cas9已经成为基础研究和基因治疗的首选基因组编辑器。但CRISPR-Cas9也催生了其他潜在的强大DNA操纵工具,从而可能帮助修复导致遗传性疾病的基因突变。在一项新的研究中,来自美国加州大学伯克利分校的研究人员如今获得了这些最有前途的工具之一---碱基编辑器---的首个详细的三维结
2020年7月31日讯/生物谷BIOON/---在短短八年内,CRISPR-Cas9已经成为基础研究和基因治疗的首选基因组编辑器。但CRISPR-Cas9也催生了其他潜在的强大DNA操纵工具,从而可能帮助修复导致遗传性疾病的基因突变。
在一项新的研究中,来自美国加州大学伯克利分校的研究人员如今获得了这些最有前途的工具之一---碱基编辑器---的首个详细的三维结构,这为调整碱基编辑器使之在患者中的使用更加灵活和可控提供了一个路线图。相关研究结果发表在2020年7月31日的Science期刊上,论文标题为“DNA capture by a CRISPR-Cas9–guided adenine base editor”。
碱基编辑器在4年前首次被构建出,可与DNA结合,但不切割DNA,而是精确地用一种核苷酸替换另一种核苷酸。它们已经用于校正人类基因组中的单核苷酸突变。在目前已知的1.5万多种遗传性疾病中,大约60%可能可以由目前可获得的碱基编辑器加以校正。
论文共同第一作者、加州大学伯克利分校博士后研究员Gavin Knott说,“我们第一次能够观察到碱基编辑器在发挥作用。如今,我们不仅可以了解它什么时候起作用,什么时候不起作用,而且还可以设计下一代碱基编辑器,使之变得更好、更适合于临床使用。”
碱基编辑器是由一种酶和部分失活的Cas9(dCas9)融合而成,其中dCas9可以结合DNA,但不切割DNA,这种酶可以激活或沉默基因,或者修改相邻的DNA区域。由于这项研究报告了这种融合蛋白的首个结构,它可能有助于指导无数其他基于Cas9的基因编辑工具的设计。
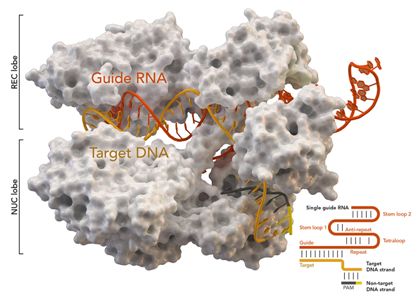
论文共同第一作者、前加州大学伯克利分校博士后研究员Audrone Lapinaite(如今为亚利桑那州立大学助理教授)说,“我们实际上第一次观察到碱基编辑器作为两个独立的模块运行:一个是dCas9模块,它提供特异性;另一个是催化模块,它提供编辑活性。我们获得的这个碱基编辑器与它的靶标结合在一起时的结构真地给了我们一种思考Cas9融合蛋白的方法,总体而言,这给我们提供了dCas9的哪个区域更有利于与其他蛋白融合在一起的想法。”
一次编辑一个碱基
2012年,科学家们首次展示了如何重新改造细菌核酸酶Cas9,将它变成在从细菌到人类的所有类型细胞中都可使用的基因编辑工具。CRISPR-Cas9是加州大学伯克利分校生物化学家Jennifer Doudna和她的法国同事Emmanuelle Charpentier的心血结晶,已改变了生物学研究,而且几十年来,首次将基因治疗进入临床。
科学家们很快就利用Cas9构建出一系列其他工具。Cas9能精确地靶向一段特定的DNA,然后就像一把剪刀一样精确地切割它。然而,Cas9的剪刀功能可以被破坏,使得它能够在不切割DNA的情况下靶向并结合DNA。通过这种方式,dCas9可以将不同的酶引导到目标DNA区域上,并让该酶操纵基因。
2016年,哈佛大学的David Liu将dCas9与另一种细菌蛋白结合起来,从而允许外科手术般地将一个核苷酸精确地替换成另一个核苷酸:他们构建出首个碱基编辑器。
早期的腺嘌呤碱基编辑器编辑速度很慢,而最新的版本,称为ABE8e,编辑速度快得惊人。它能在15分钟内完成近100%的碱基编辑工作。然而,在试管中,ABE8e可能更容易编辑非预期的DNA片段,有可能产生所谓的脱靶效应。
这项研究揭示的结构是通过一种强大的称为低温电子显微镜(cryoEM)的成像技术获得的。活性检测显示了为何ABE8e容易产生更多的脱靶编辑:与dCas9融合在一起的脱氨酶蛋白始终处于活性状态。当dCas9在细胞核中跳动时,它在找到预定目标之前,会结合数百或数千个DNA片段并脱落下来。与它融合在一起的脱氨酶就像一门松散的大炮,不会等待完美的匹配,往往在dCas9找到最终的目标之前就会编辑碱基。
了解脱氨酶和dCas9是如何连接在一起的,可以使得人们对此进行重新设计,以便让这种酶只有在Cas9找到靶标后才有活性。
Lapinaite说,“如果你真地想设计出真正特异性的融合蛋白,你必须找到一种方法使得催化结构域更多地成为dCas9的一部分,这样它就会在感知dCas9找到正确的靶标时才会被激活,而不是一直处于活性状态。”
ABE8e的结构还精确地指出了脱氨酶蛋白中的两个特殊变化(即两个点突变),这些变化使得这种碱基编辑器比它的早期版本ABE7.10更快地工作。这两个点突变使得这种蛋白能够更紧密地抓住DNA,更有效地将A替换成G。
Knott补充道,“作为一个结构生物学者,我真地很想研究一种分子,并思考如何合理地改进它。这种结构和伴随的生物化学特性真地给了我们这种力量。我们如今可以对这个编辑系统在细胞中的行为做出理性的预测,这是因为我们可以看到它并预测它将如何破坏DNA或者预测如何让它变得更好。”(生物谷 Bioon.com)
参考资料:
1. Audrone Lapinaite et al. DNA capture by a CRISPR-Cas9–guided adenine base editor. Science, 2020, doi:10.1126/science.abb1390.
2. New understanding of CRISPR-Cas9 tool could improve gene editing
https://phys.org/news/2020-07-crispr-cas9-tool-gene.html
在一项新的研究中,来自美国加州大学伯克利分校的研究人员如今获得了这些最有前途的工具之一---碱基编辑器---的首个详细的三维结构,这为调整碱基编辑器使之在患者中的使用更加灵活和可控提供了一个路线图。相关研究结果发表在2020年7月31日的Science期刊上,论文标题为“DNA capture by a CRISPR-Cas9–guided adenine base editor”。
碱基编辑器在4年前首次被构建出,可与DNA结合,但不切割DNA,而是精确地用一种核苷酸替换另一种核苷酸。它们已经用于校正人类基因组中的单核苷酸突变。在目前已知的1.5万多种遗传性疾病中,大约60%可能可以由目前可获得的碱基编辑器加以校正。
论文共同第一作者、加州大学伯克利分校博士后研究员Gavin Knott说,“我们第一次能够观察到碱基编辑器在发挥作用。如今,我们不仅可以了解它什么时候起作用,什么时候不起作用,而且还可以设计下一代碱基编辑器,使之变得更好、更适合于临床使用。”
碱基编辑器是由一种酶和部分失活的Cas9(dCas9)融合而成,其中dCas9可以结合DNA,但不切割DNA,这种酶可以激活或沉默基因,或者修改相邻的DNA区域。由于这项研究报告了这种融合蛋白的首个结构,它可能有助于指导无数其他基于Cas9的基因编辑工具的设计。

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
论文共同第一作者、前加州大学伯克利分校博士后研究员Audrone Lapinaite(如今为亚利桑那州立大学助理教授)说,“我们实际上第一次观察到碱基编辑器作为两个独立的模块运行:一个是dCas9模块,它提供特异性;另一个是催化模块,它提供编辑活性。我们获得的这个碱基编辑器与它的靶标结合在一起时的结构真地给了我们一种思考Cas9融合蛋白的方法,总体而言,这给我们提供了dCas9的哪个区域更有利于与其他蛋白融合在一起的想法。”
一次编辑一个碱基
2012年,科学家们首次展示了如何重新改造细菌核酸酶Cas9,将它变成在从细菌到人类的所有类型细胞中都可使用的基因编辑工具。CRISPR-Cas9是加州大学伯克利分校生物化学家Jennifer Doudna和她的法国同事Emmanuelle Charpentier的心血结晶,已改变了生物学研究,而且几十年来,首次将基因治疗进入临床。
科学家们很快就利用Cas9构建出一系列其他工具。Cas9能精确地靶向一段特定的DNA,然后就像一把剪刀一样精确地切割它。然而,Cas9的剪刀功能可以被破坏,使得它能够在不切割DNA的情况下靶向并结合DNA。通过这种方式,dCas9可以将不同的酶引导到目标DNA区域上,并让该酶操纵基因。
2016年,哈佛大学的David Liu将dCas9与另一种细菌蛋白结合起来,从而允许外科手术般地将一个核苷酸精确地替换成另一个核苷酸:他们构建出首个碱基编辑器。
早期的腺嘌呤碱基编辑器编辑速度很慢,而最新的版本,称为ABE8e,编辑速度快得惊人。它能在15分钟内完成近100%的碱基编辑工作。然而,在试管中,ABE8e可能更容易编辑非预期的DNA片段,有可能产生所谓的脱靶效应。
这项研究揭示的结构是通过一种强大的称为低温电子显微镜(cryoEM)的成像技术获得的。活性检测显示了为何ABE8e容易产生更多的脱靶编辑:与dCas9融合在一起的脱氨酶蛋白始终处于活性状态。当dCas9在细胞核中跳动时,它在找到预定目标之前,会结合数百或数千个DNA片段并脱落下来。与它融合在一起的脱氨酶就像一门松散的大炮,不会等待完美的匹配,往往在dCas9找到最终的目标之前就会编辑碱基。
了解脱氨酶和dCas9是如何连接在一起的,可以使得人们对此进行重新设计,以便让这种酶只有在Cas9找到靶标后才有活性。
Lapinaite说,“如果你真地想设计出真正特异性的融合蛋白,你必须找到一种方法使得催化结构域更多地成为dCas9的一部分,这样它就会在感知dCas9找到正确的靶标时才会被激活,而不是一直处于活性状态。”
ABE8e的结构还精确地指出了脱氨酶蛋白中的两个特殊变化(即两个点突变),这些变化使得这种碱基编辑器比它的早期版本ABE7.10更快地工作。这两个点突变使得这种蛋白能够更紧密地抓住DNA,更有效地将A替换成G。
Knott补充道,“作为一个结构生物学者,我真地很想研究一种分子,并思考如何合理地改进它。这种结构和伴随的生物化学特性真地给了我们这种力量。我们如今可以对这个编辑系统在细胞中的行为做出理性的预测,这是因为我们可以看到它并预测它将如何破坏DNA或者预测如何让它变得更好。”(生物谷 Bioon.com)
参考资料:
1. Audrone Lapinaite et al. DNA capture by a CRISPR-Cas9–guided adenine base editor. Science, 2020, doi:10.1126/science.abb1390.
2. New understanding of CRISPR-Cas9 tool could improve gene editing
https://phys.org/news/2020-07-crispr-cas9-tool-gene.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


