强生S1P1调节剂Ponvory(ponesimod)获美国FDA批准:疗效击败赛诺菲Aubagio!
在中国,Aubagio(奥巴捷)已于2018年7月上市,是国内首个疾病修正口服疗法。
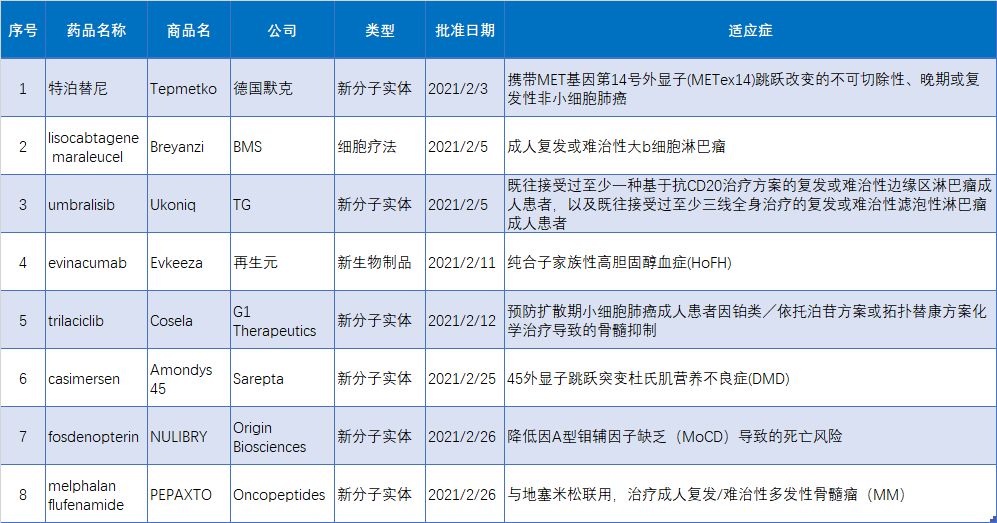
2021年2月 FDA批准的8款新药
2020年2月FDA共批准8款新药(不包括疫苗),包括6款新分子实体,1款单抗类生物制品,1款细胞疗法。2021年2月FDA批准的新药1. Tepmetko(特泊替尼)2月3日,FDA通过优先审评方式批准德国默克旗下公司EMD Serono开发的MET抑制剂tepotinib(商品名:TEPMETKO)上市,用于治疗携带MET基因第1
FDA批准第三款新冠疫苗紧急使用授权
美国食品和药物管理局(FDA)批准强生公司(Johnson&Johnson)生产的新冠疫苗可在美国紧急使用,适用于18岁及以上人群预防由新型冠状病毒感染引起的疾病(COVID-19)。这是继美国制药商辉瑞公司与德国公司BioNTech合作开发的第一种疫苗以及美国制药商Moderna公司开发的第二种疫苗之后,第三种在该国获得
康宁杰瑞PD-L1/CTLA-4双抗KN046美国Ⅱ期注册临床IND获FDA批准
3月9日,康宁杰瑞生物制药宣布,PD-L1/CTLA-4双特异性抗体KN046的关键临床IND获得美国食品药品监督管理局(FDA)批准,同意在美国开展一项开放、多中心的Ⅱ期注册临床研究(研究编号:KN046-205, ENREACH-Thymic),旨在评估KN046(PD-L1/CTLA-4双特异性抗体)治疗胸腺癌的有效
国家药监局批准清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒上市
3月2日,国家药品监督管理局通过特别审批程序应急批准中国中医科学院中医临床基础医学研究所的清肺排毒颗粒、广东一方制药有限公司的化湿败毒颗粒、山东步长制药股份有限公司的宣肺败毒颗粒上市。据介绍,清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒是新冠肺炎疫情爆发以来,在武汉抗疫临床一线众多院士专家筛选出有效方药清肺排毒汤、化湿败毒方、宣肺败毒方的
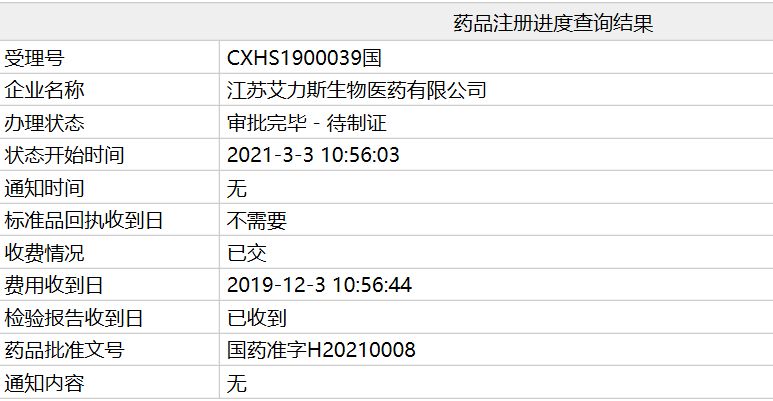
艾力斯三代EGFR-TKI甲磺酸伏美替尼获NMPA批准上市
国家局官网显示,艾力斯医药第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)甲磺酸伏美替尼已获NMPA批准上市,用于治疗EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)。我国NSCLC患者EGFR敏感突变率约为50%,这类患者常规使用第一/二代EGFR-TKI治疗。但多数患者在接受治疗一年左右出现耐药和
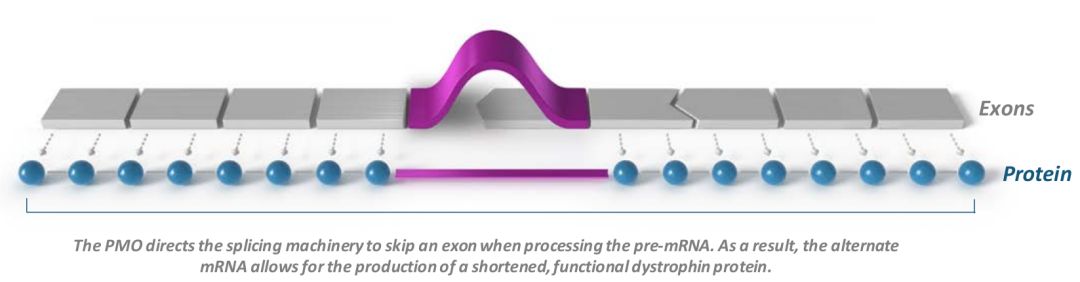
Sarepta公司第3款反义寡核苷酸疗法获FDA批准上市
罕见病精准基因治疗领域领导者Sarepta公司宣布,FDA已批准反义寡核苷酸药物AMONDYS 45 (casimersen)上市,用于45外显子跳跃突变杜氏肌营养不良症(DMD)患者治疗。这是Sarepta获批的第3款反义寡核苷疗法。此前,Sarepta的反义寡核苷疗法依特立生已于2016年9月获FDA批准用于治疗经证实具有51外显
辉瑞/BioNTech 疫苗获FDA批准可在正常冷冻温度下保存2周
美国食品药物管理局(FDA)宣布,批准辉瑞/BioNTech mRNA疫苗(商品名:Comirnaty )在常规药品冷冻箱温度下(-25℃至-15℃)运输和储存2周时间。以作为在超低温(-80℃至-60℃)冰箱中储存的替代或补充。Comirnaty 是基于BioNTech专有mRNA技术,由辉瑞和BioNTech 共同开发