国家药监局发布基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查等5项注册技术审查指导原则的通告
近日,为加强医疗器械产品注册工作的监督和指导,国家药监局官网发布基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查等5项注册技术审查指导原则的通告。原文如下:为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查指导原则》《实时荧光PCR
珀金埃尔默推出首个细胞全景绘制即用试剂系列
致力于以创新打造更健康世界的技术型企业珀金埃尔默,最新推出首个细胞全景绘制即用试剂盒PhenoVue™,并与其全新的细胞成像试剂系列产品进行全球同步发布。细胞成像新试剂系列全面匹配珀金埃尔默成像微孔板、全自动细胞样品准备系统、高内涵成像系统和大数据智能分析技术,共同组成了针对小分子、siRNA、CRISPR、天然产物库等药物筛选的即用型高通量解决
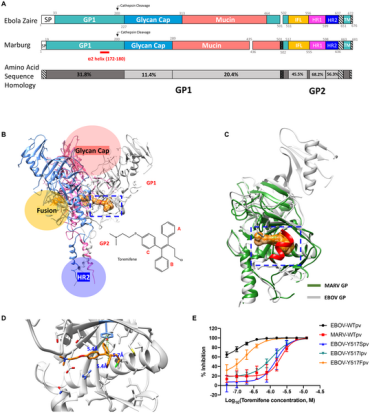
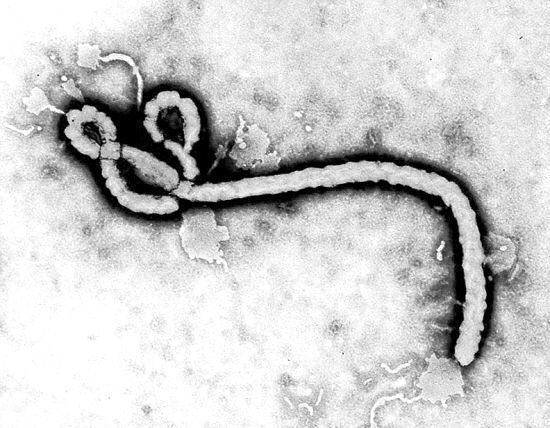
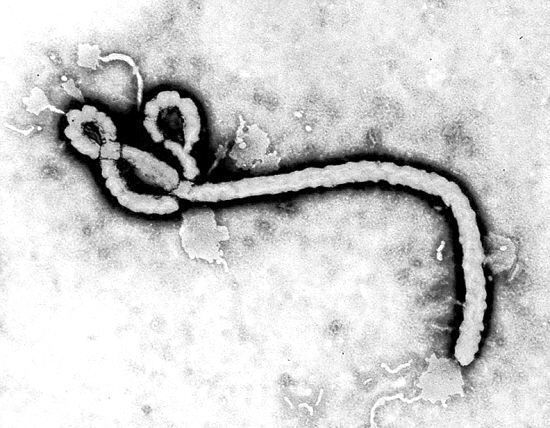
PLoS Pathog:揭示小分子药物抑制埃博拉病毒和马尔堡病毒等丝状病毒机制
2021年2月12日讯/生物谷BIOON/---埃博拉病毒和马尔堡病毒属于一类称为丝状病毒的病毒,已知它们会引起出血热。这两种病毒是最致命的病毒之一,它们感染的死亡率在25%到90%之间。虽然目前市场上没有任何药物可以预防这两种病毒的感染,但是人们已经发现了一些小的药物分子可以通过占据病毒糖蛋白上的单个位点来阻止丝状病毒感染细胞。如今,在一项新的研究中,来自
PNAS:可以感染人类的雷斯顿埃博拉病毒能在猪体内高效传播
2020年12月22日讯/生物谷BIOON/---在一项新的研究中,来自美国国家过敏症与传染病研究所(NIAID)的研究人员发现雷斯顿埃博拉病毒(Reston ebolavirus, RESTV)感染的实验幼猪会出现严重的呼吸道疾病,并从它们的上呼吸道脱落这种病毒。RESTV可以感染人类,但目前还不知道会引起疾病。据此,他们表示,RESTV应当被视为一种家畜
美国FDA批准第二款埃博拉药物:单抗药物Ebanga(mAb114)获批,单次治疗大幅降低死亡率!
Ebanga(mAb114)是继Inmazeb(三抗鸡尾酒)之后FDA批准的第二款埃博拉药物。
Cell:对埃博拉病毒进行单细胞研究,揭示了这种病毒的致命策略
2020年11月15日讯/生物谷BIOON/---埃博拉病毒是世界上最致命的病原体之一。如今,在一项新的研究中,来自美国国家卫生研究院(NIH)、布罗德研究所、麻省理工学院和斯坦福大学等研究机构的研究人员报告了埃博拉病毒在感染过程中如何改变宿主免疫反应以有利于自己的新细节。他们鉴定出这种病毒抑制的抗病毒防御基因,以及这种病毒激活的其他基因,以便潜在地促进它在
凯普生物体外诊断试剂取得医疗器械注册证书
凯普生物发布公告称,其全资子公司广州凯普医药科技有限公司近日取得国家药品监督管理局颁发的《中华人民共和国医疗器械注册证(体外诊断试剂)》。具体情况如下:产品名称CYP2C9、VKORC1基因多态性检测试剂盒(PCR+导流杂交法)注册分类III类注册证编号国械注准20203400809注册证有效期2020年10月26日至2025年10月25日预期用
再生元中和抗体组合疗法成为首款FDA批准埃博拉疗法
今天,美国FDA宣布,批准再生元(Regeneron)公司开发的中和抗体鸡尾酒疗法Inmazeb(atoltivimab、maftivimab和odesivimab-ebgn,曾用名REGN-EB3)上市,治疗成人和儿童埃博拉病毒感染。这是FDA批准的首个治疗埃博拉病毒感染的药物。埃博拉病毒(Ebola virus)可以导致潜在致命的人类疾病。它
改良PET扫描 FDA批准新型放射性诊断试剂上市
日前,FDA官网信息显示,FDA已经批准由RadioMedix和Curium联合开发的放射性诊断试剂Detectnet(Cu 64 DOTATATE)上市。用于使用正电子发射断层扫描(PET),在成人中发现生长抑素(somatostatin, SST)受体阳性的神经内分泌瘤(NETs)。此前,RadioMedix的新闻稿指出,这是首款将Cu 64放射性同位素