PLoS Pathog:重大进展!鉴定出一种潜在新的潜伏HIV病毒库
来源:本站原创 2020-05-12 22:52
2020年5月12日讯/生物谷BIOON/---科学家们早就知道,即使接受抗逆转录病毒治疗,一些HIV也会永远存在于感染者体内,隐藏在免疫系统的较小细胞库(亦即HIV病毒库,指的是HIV整合到宿主免疫细胞基因组中而不再活跃地增殖)中。当患者停止治疗后,这种病毒几乎总是从HIV病毒库中迅速反弹,导致致命的症状再次出现。这些HIV病毒库仍然是治愈HIV/AIDS
2020年5月12日讯/生物谷BIOON/---科学家们早就知道,即使接受抗逆转录病毒治疗,一些HIV也会永远存在于感染者体内,隐藏在免疫系统的较小细胞库(亦即HIV病毒库,指的是HIV整合到宿主免疫细胞基因组中而不再活跃地增殖)中。当患者停止治疗后,这种病毒几乎总是从HIV病毒库中迅速反弹,导致致命的症状再次出现。
这些HIV病毒库仍然是治愈HIV/AIDS的主要障碍。但是,目前还没有一种简单的方法可以靶向病毒库细胞以便进行清除。科学家们也无法有效地从患者身上提取出病毒库细胞进行研究,以便最终找到控制它们的方法。原因在于,这些细胞中的HIV病毒是潜伏的。因此,这些细胞的表面并没有携带易被宿主免疫系统发现的病毒蛋白。因此,科学家们一直在寻找其他的方法来精确地找到病毒库细胞。
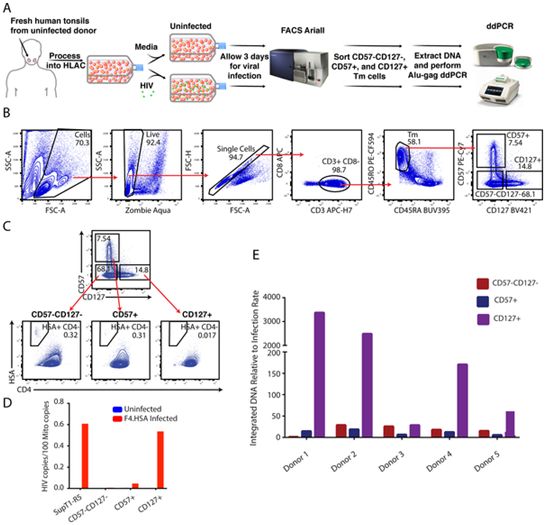
在一项新的研究中,美国格拉德斯通病毒学和免疫学研究所访问学者Nadia Roan博士和她的团队描述了一类优先支持HIV潜伏感染的细胞。这些细胞表达表面蛋白CD127,存在于淋巴结等组织中,并被认为它们携带的HIV病毒库比血液中的更多。相关研究结果近期发表在PLoS Pathogens期刊上,论文标题为“Tissue memory CD4+ T cells expressing IL-7 receptor-alpha (CD127) preferentially support latent HIV-1 infection”。
Roan说,“我们的研究结果表明,组织中的CD127阳性细胞可能是治愈HIV感染的重要靶点。”
此外,科学家们可能会利用CD127蛋白从患者中分离出病毒库细胞,并研究是什么让它们能够让HIV沉默,偶尔重新激活这种病毒。
新的病毒库?
HIV靶向攻击主要存在于淋巴结和扁桃体等淋巴组织中的T细胞。然而,HIV感染研究主要集中在血液中循环的T细胞上,而血液中的T细胞相对容易获得----相比于组织活检,志愿者更容易接受抽血。但关注血液中存在的T细胞,很可能会让科学家们对病毒库组成的认识存在偏差。
Roan说,“长期以来,我们一直猜测病毒库细胞有不同的种类,不同的组织容纳着不同类型的病毒库细胞。但这一点一直难以证明,这是因为HIV感染者体内的病毒库细胞是非常罕见的。绝大多数的体外HIV潜伏模型使用的是细胞系或血液中循环的细胞。”
相比之下,Roan和她的团队一直在使用组织样本研究HIV感染。在之前的研究工作中,她的团队在实验室里将扁桃体细胞暴露在HIV中,以观察哪些细胞最容易被感染。通过使用各种实验方法,她的团队发现,表达表面蛋白CD127的扁桃体细胞能有效地摄取HIV病毒,但很少让它复制。相比之下,另一种表面携带CD57的扁桃体细胞很容易支持有成效的HIV感染。
这是有趣的,但这并不意味着CD127阳性细胞是病毒库细胞。论文共同第一作者、Roan实验室前研究员Feng Hsiao说,“在HIV进入细胞后,细胞仍然有办法逃脱感染。”
一种方法是防止HIV复制它的基因组。与人体细胞的基因组不同,HIV的基因组是由RNA组成的。这种病毒进入细胞后的首批任务之一是利用一种称为逆转录酶的病毒酶,将它的RNA基因组转化为对应的DNA拷贝。
细胞可以通过激活一种叫做SAMHD1的酶来阻碍这一步骤,其中这种酶会消耗HIV复制它的基因组所需的构成单元(building block,这里指的是核苷酸)。有一些证据表明,这种机制可能在血细胞中发挥作用。
然而,在这项新的研究中,Roan和她的团队发现,通过基因操纵剔除SAMHD1并不能让CD127阳性细胞产生HIV,即便这样做可以促进CD57阳性细胞产生这种病毒。
论文共同第一作者、Roan实验室的博士后学者Julie Frouard博士说,“这提示着CD127阳性细胞在HIV生命周期的后期阻止了这种病毒的产生。”
对潜伏感染的偏好
HIV的下一步是将它的基因组拷贝整合到宿主细胞的DNA中。一旦整合成功,病毒基因就可以利用细胞中的分子机器产生它们自己的蛋白,组装新的病毒颗粒,以便去感染其他的细胞。
病毒库细胞在它们自己的基因组中整合了HIV的遗传物质,尽管它们会以某种方式让它沉默。这种遗传物质的偶尔调动允许释放出传染性的HIV。CD127阳性扁桃体细胞是否允许HIV基因组整合?
为了回答这个问题,Roan团队在实验室中提取了接触过HIV的CD127阳性细胞和CD57阳性细胞的基因组。通过使用可以特异性检测整合的HIV病毒DNA序列的遗传工具,他们发现这两种类型的细胞都含有HIV基因组的拷贝,尽管CD127阳性细胞产生的HIV远远少于CD57阳性细胞。CD127阳性细胞似乎更倾向于HIV潜伏感染。
然而,在CD127阳性细胞中成功整合的HIV并不会永远沉默。Roan和她的团队发现,通过用已知的刺激T细胞的试剂处理受到HIV潜伏感染的CD127阳性细胞,他们可以诱导这些细胞重新激活HIV。
因此,CD127阳性组织细胞很可能在体内充当病毒库细胞,在大部分时间内让这种病毒保持在潜伏状态,但偶尔也能激活这种病毒,从而释放出新一轮感染的种子。
Roan说,“一种特定类型的组织T细胞优先支持HIV潜伏感染的能力是令人关注的,这可以让我们更多地了解关于组织中的病毒库最初是如何建立的。”
控制病毒库
CD127阳性细胞在多大程度上是HIV感染者体内病毒库的主要组成部分,有待于对这些来自多个组织部位的细胞进行后续研究分析。Roan团队的初步研究令人鼓舞,这是因为他们表明,细胞表面的CD127标志物确实可以用来从感染者体内纯化出足够多的被HIV感染的组织细胞,以便进一步分析。
与此同时,Roan说,“在体外暴露于HIV的CD127阳性扁桃体细胞提供了一个研究组织中病毒潜伏的新模型。”
Roan和她的团队已经开始分析是什么使得CD127阳性细胞极其容易发生潜伏感染。通过比较CD127阳性扁桃体细胞和CD57阳性扁桃体细胞中表达的所有基因,他们发现有证据表明CD127阳性扁桃体细胞处于静止状态,这可能会阻止病毒基因的表达。此外,他们还发现病毒的基因转录产物,即RNA,未能经过必要的加工而不能够制造病毒蛋白。
Roan说,“最终,我们希望我们发现的机制可以被利用来控制潜伏的病毒库,从而使得我们更接近于实现治愈HIV感染的目标。”(生物谷 Bioon.com)
参考资料:
1.Feng Hsiao et al. Tissue memory CD4+ T cells expressing IL-7 receptor-alpha (CD127) preferentially support latent HIV-1 infection. PLoS Pathogens, 2020, doi:10.1371/journal.ppat.1008450.
2.Scientists identify a new potential reservoir of latent HIV
https://medicalxpress.com/news/2020-04-scientists-potential-reservoir-latent-hiv.html
这些HIV病毒库仍然是治愈HIV/AIDS的主要障碍。但是,目前还没有一种简单的方法可以靶向病毒库细胞以便进行清除。科学家们也无法有效地从患者身上提取出病毒库细胞进行研究,以便最终找到控制它们的方法。原因在于,这些细胞中的HIV病毒是潜伏的。因此,这些细胞的表面并没有携带易被宿主免疫系统发现的病毒蛋白。因此,科学家们一直在寻找其他的方法来精确地找到病毒库细胞。
在一项新的研究中,美国格拉德斯通病毒学和免疫学研究所访问学者Nadia Roan博士和她的团队描述了一类优先支持HIV潜伏感染的细胞。这些细胞表达表面蛋白CD127,存在于淋巴结等组织中,并被认为它们携带的HIV病毒库比血液中的更多。相关研究结果近期发表在PLoS Pathogens期刊上,论文标题为“Tissue memory CD4+ T cells expressing IL-7 receptor-alpha (CD127) preferentially support latent HIV-1 infection”。

图片来自PLoS Pathogens, 2020, doi:10.1371/journal.ppat.1008450。
Roan说,“我们的研究结果表明,组织中的CD127阳性细胞可能是治愈HIV感染的重要靶点。”
此外,科学家们可能会利用CD127蛋白从患者中分离出病毒库细胞,并研究是什么让它们能够让HIV沉默,偶尔重新激活这种病毒。
新的病毒库?
HIV靶向攻击主要存在于淋巴结和扁桃体等淋巴组织中的T细胞。然而,HIV感染研究主要集中在血液中循环的T细胞上,而血液中的T细胞相对容易获得----相比于组织活检,志愿者更容易接受抽血。但关注血液中存在的T细胞,很可能会让科学家们对病毒库组成的认识存在偏差。
Roan说,“长期以来,我们一直猜测病毒库细胞有不同的种类,不同的组织容纳着不同类型的病毒库细胞。但这一点一直难以证明,这是因为HIV感染者体内的病毒库细胞是非常罕见的。绝大多数的体外HIV潜伏模型使用的是细胞系或血液中循环的细胞。”
相比之下,Roan和她的团队一直在使用组织样本研究HIV感染。在之前的研究工作中,她的团队在实验室里将扁桃体细胞暴露在HIV中,以观察哪些细胞最容易被感染。通过使用各种实验方法,她的团队发现,表达表面蛋白CD127的扁桃体细胞能有效地摄取HIV病毒,但很少让它复制。相比之下,另一种表面携带CD57的扁桃体细胞很容易支持有成效的HIV感染。
这是有趣的,但这并不意味着CD127阳性细胞是病毒库细胞。论文共同第一作者、Roan实验室前研究员Feng Hsiao说,“在HIV进入细胞后,细胞仍然有办法逃脱感染。”
一种方法是防止HIV复制它的基因组。与人体细胞的基因组不同,HIV的基因组是由RNA组成的。这种病毒进入细胞后的首批任务之一是利用一种称为逆转录酶的病毒酶,将它的RNA基因组转化为对应的DNA拷贝。
细胞可以通过激活一种叫做SAMHD1的酶来阻碍这一步骤,其中这种酶会消耗HIV复制它的基因组所需的构成单元(building block,这里指的是核苷酸)。有一些证据表明,这种机制可能在血细胞中发挥作用。
然而,在这项新的研究中,Roan和她的团队发现,通过基因操纵剔除SAMHD1并不能让CD127阳性细胞产生HIV,即便这样做可以促进CD57阳性细胞产生这种病毒。
论文共同第一作者、Roan实验室的博士后学者Julie Frouard博士说,“这提示着CD127阳性细胞在HIV生命周期的后期阻止了这种病毒的产生。”
对潜伏感染的偏好
HIV的下一步是将它的基因组拷贝整合到宿主细胞的DNA中。一旦整合成功,病毒基因就可以利用细胞中的分子机器产生它们自己的蛋白,组装新的病毒颗粒,以便去感染其他的细胞。
病毒库细胞在它们自己的基因组中整合了HIV的遗传物质,尽管它们会以某种方式让它沉默。这种遗传物质的偶尔调动允许释放出传染性的HIV。CD127阳性扁桃体细胞是否允许HIV基因组整合?
为了回答这个问题,Roan团队在实验室中提取了接触过HIV的CD127阳性细胞和CD57阳性细胞的基因组。通过使用可以特异性检测整合的HIV病毒DNA序列的遗传工具,他们发现这两种类型的细胞都含有HIV基因组的拷贝,尽管CD127阳性细胞产生的HIV远远少于CD57阳性细胞。CD127阳性细胞似乎更倾向于HIV潜伏感染。
然而,在CD127阳性细胞中成功整合的HIV并不会永远沉默。Roan和她的团队发现,通过用已知的刺激T细胞的试剂处理受到HIV潜伏感染的CD127阳性细胞,他们可以诱导这些细胞重新激活HIV。
因此,CD127阳性组织细胞很可能在体内充当病毒库细胞,在大部分时间内让这种病毒保持在潜伏状态,但偶尔也能激活这种病毒,从而释放出新一轮感染的种子。
Roan说,“一种特定类型的组织T细胞优先支持HIV潜伏感染的能力是令人关注的,这可以让我们更多地了解关于组织中的病毒库最初是如何建立的。”
控制病毒库
CD127阳性细胞在多大程度上是HIV感染者体内病毒库的主要组成部分,有待于对这些来自多个组织部位的细胞进行后续研究分析。Roan团队的初步研究令人鼓舞,这是因为他们表明,细胞表面的CD127标志物确实可以用来从感染者体内纯化出足够多的被HIV感染的组织细胞,以便进一步分析。
与此同时,Roan说,“在体外暴露于HIV的CD127阳性扁桃体细胞提供了一个研究组织中病毒潜伏的新模型。”
Roan和她的团队已经开始分析是什么使得CD127阳性细胞极其容易发生潜伏感染。通过比较CD127阳性扁桃体细胞和CD57阳性扁桃体细胞中表达的所有基因,他们发现有证据表明CD127阳性扁桃体细胞处于静止状态,这可能会阻止病毒基因的表达。此外,他们还发现病毒的基因转录产物,即RNA,未能经过必要的加工而不能够制造病毒蛋白。
Roan说,“最终,我们希望我们发现的机制可以被利用来控制潜伏的病毒库,从而使得我们更接近于实现治愈HIV感染的目标。”(生物谷 Bioon.com)
参考资料:
1.Feng Hsiao et al. Tissue memory CD4+ T cells expressing IL-7 receptor-alpha (CD127) preferentially support latent HIV-1 infection. PLoS Pathogens, 2020, doi:10.1371/journal.ppat.1008450.
2.Scientists identify a new potential reservoir of latent HIV
https://medicalxpress.com/news/2020-04-scientists-potential-reservoir-latent-hiv.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


