Cell:重磅!揭示新型冠状病毒SARS-CoV-2刺突糖蛋白的结构、功能和抗原性
来源:本站原创 2020-03-03 23:52
2020年3月3日讯/生物谷BIOON/---自21世纪初以来,三种冠状病毒已越过物种壁垒,导致人类致命的肺炎:严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)、中东呼吸综合征(MERS)冠状病毒(MERS-CoV)和SARS-CoV-2(之前称为2019年新型冠状病毒, 2019-nCoV)。SARS-CoV于2002年在中国广东省出现,并通过航
2020年3月3日讯/生物谷BIOON/---自21世纪初以来,三种冠状病毒已越过物种壁垒,导致人类致命的肺炎:严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)、中东呼吸综合征(MERS)冠状病毒(MERS-CoV)和SARS-CoV-2(之前称为2019年新型冠状病毒, 2019-nCoV)。
SARS-CoV于2002年在中国广东省出现,并通过航空旅行路线传播到五大洲,感染8098人,造成774人死亡。2012年,MERS-CoV出现在阿拉伯半岛,并传播到27个国家,共感染约2494人,并夺走了858人的生命。如今,它仍然是阿拉伯半岛的一个主要的公共卫生问题。2019年12月在中国湖北省武汉市发现了一种以前未知的冠状病毒SARS-CoV-2,并于2020年1月对它进行了分离和测序。SARS-CoV-2与正在进行的非典型肺炎(Covid-2019)有关,截至2020年2月15日,它已影响29个国家的80000多人,并杀死了2700多人。2020年1月30日,世界卫生组织(WHO)宣布SARS-CoV-2疫情是国际关注的突发公共卫生事件。
MERS-CoV被认为起源于蝙蝠,但促进它溢出到人类的中间宿主是单峰骆驼。SARS-CoV和SARS-CoV-2彼此密切相关,都起源于蝙蝠,因此蝙蝠最有可能是这两种病毒的天然宿主。尽管果子狸已被公认是在蝙蝠和人类之间传播人畜共患病病原体SARS-CoV的中间宿主,但是SARS-CoV-2的中间宿主仍然未知。
冠状病毒在人类中多次溢出以及在蝙蝠中检测到许多冠状病毒,包括许多SARS相关冠状病毒(SARS-related coronavirus, SARSr-CoV),这提示着未来的人畜共患病传播事件可能会继续发生。除高致病性的属于β-冠状病毒属的人畜共患病病原体SARS-CoV、MERS-CoV和SARS-CoV-2之外,四种低致病性冠状病毒是人类特有的:HCoV-OC43、HCoV-HKU1、HCoV-NL63和HCoV-229E。迄今为止,尚未批准针对任何感染人类的冠状病毒的药物或疫苗。
冠状病毒进入宿主细胞是由跨膜刺突(S)糖蛋白(下称S蛋白)介导的,其中S蛋白形成从病毒表面突出的同型三聚体。S蛋白包含两个功能性亚基S1和S2,其中S1负责与宿主细胞受体结合,S2亚基负责病毒膜和细胞膜融合。对于许多冠状病毒而言,S蛋白在S1和S2亚基之间的边界处受到切割,而S1和S2亚基在融合前的构象中保持非共价结合。位于远端的S1亚基包含受体结合结构域,并有助于稳定包含融合装置(fusion machinery)的膜锚定S2亚基的融合前状态。对于所有的冠状病毒而言,S蛋白会在紧邻融合肽上游的所谓S2'位点被宿主蛋白酶进一步切割。有人已经提出这种进一步切割通过广泛的不可逆的构象变化激活S蛋白以进行膜融合。由此可知,冠状病毒进入易感细胞是一种复杂的过程,需要S蛋白的受体结合和蛋白水解过程协同作用以促进病毒-细胞融合。
不同的冠状病毒使用S1亚基内的不同结构域来识别各种附着受体和进入受体,这取决于冠状病毒种类。地方性人类冠状病毒HCoV-OC43和HCoV-HKU1通过S蛋白的结构域A(下称结构域A)附着到位于宿主细胞表面的糖蛋白和糖脂上的5-N-乙酰基-9-O-乙酰基唾液酸苷,从而使得它们能够进入易感细胞。然而,MERS-CoV的S蛋白使用结构域A来识别非乙酰化唾液苷附着受体,这可能会促进S蛋白的结构域B(下称结构域B)随后与一种称为二肽基结合肽酶4的进入受体结合。SARS-CoV和几种SARSr-CoV通过结构域B与血管紧张素转化酶2(ACE2)直接相互作用而进入靶细胞。
由于冠状病毒S蛋白暴露于病毒表面并介导病毒进入宿主细胞,因此它是感染后中和抗体的主要靶标,也是药物开发和疫苗设计的重点。S蛋白三聚体受到N-连接聚糖的广泛修饰,这对于它们的正确折叠和调节宿主蛋白酶和中和抗体的可接触性至关重要。美国华盛顿大学医学院生物化学系的David Veesler博士及其团队之前描述了从SARS-CoV或MERS-CoV感染者的罕见记忆B细胞中分离出强效的与SARS-CoV或MERS-CoV的S蛋白结合在一起的人类中和抗体,这就为竞争性抑制结构域B附着到宿主受体上的机制提供了分子水平上的信息(Cell, 2019, doi:10.1016/j.cell.2018.12.028)。作为这种针对SARS-CoV S蛋白的人类中和抗体,抗SARS-CoV抗体S230还可在功能上模拟受体附着和通过一种揭示这种冠状病毒膜融合激活独特性质的分子棘轮机制(molecular ratcheting mechanism)促进病毒刺突融合构象重排。
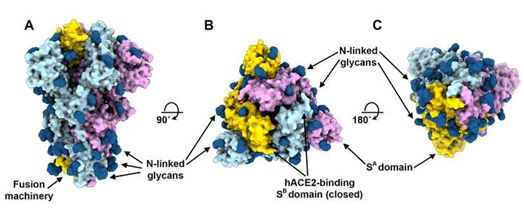
在一项新的研究中,Veesler团队报道人ACE2可调节SARS-CoV-2 S蛋白介导的细胞进入,从而确定它是这种新出现的冠状病毒的功能性受体。SARS-CoV-2 S蛋白的结构域B与人ACE2结合的亲和力与来自与2002-2003年SARS疫情相关的SARS-CoV分离株的S蛋白的结构域B相当,这表明SARS-CoV-2 S蛋白的结构域B与人ACE2具有较高的结合亲和力。与人ACE2的紧密结合可以部分解释SARS-CoV-2在人类中的有效传播,就像SARS-CoV的情况一样。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Structure, function and antigenicity of the SARS-CoV-2 spike glycoprotein”。
他们鉴定出在SARS-CoV-2 S蛋白的S1/S2亚基边界存在意料之外的弗林蛋白酶(furin)切割位点,这个位点在S蛋白的生物合成过程中被切割,这种新特征可将这种冠状病毒与SARS-CoV和SARSr-CoV区分开来。正如针对一些高致病性禽流感病毒和致病性新城疫病毒的报道那样,移除这种切割基序会适度影响SARS-CoV-2 S蛋白介导的VeroE6或BHK细胞进入,但是这可能有助于扩大这种冠状病毒的宿主趋向性。
他们解析出SARS-CoV-2 S蛋白胞外结构域三聚体的低温电镜结构,并揭示它具有多个结构域B构象,这使人想起了先前有关SARS-CoV S蛋白和MERS-CoV S蛋白的报道。他们证实SARS-CoV S蛋白小鼠多克隆血清有效抑制SARS-CoV-2 S假病毒进入靶细胞。这些结果为设计可广泛预防SARS-CoV-2、SARS-CoV和SARS-CoV的疫苗铺平了道路。
受体识别是病毒感染的第一步,也是宿主细胞和组织趋向性的关键决定因素。有人已提出SARS-CoV S蛋白与人ACE2之间的结合亲和力增强与人类中的病毒传播性和疾病严重性增加相关。确实,来自2002-2003年SARS疫情的三个阶段的SARS-CoV分离株在人与人之间的传播效率和致病性方面要比与2003-2004年仅导致少量病例的SARS疫情再出现相关的分离株更高,这与它们与人ACE2的结合亲和力相一致。而且,与不同动物物种的ACE2结合的能力似乎反映了宿主对SARS-CoV感染的易感性,并促进了这种病毒从动物向人类的跳跃。在这项新的研究中,这些研究人员报道SARS-CoV-2使用人ACE2作为进入受体,它结合人ACE2的亲和力与2002-2003 SARS-CoV分离株相似,这提示着它能够在人类中有效传播,这与迄今为止报道的大量SARS-CoV-2人际传播事件相一致。
除了S蛋白与宿主细胞受体结合外,宿主蛋白酶通过在S蛋白的S1/S2和S2'位点进行切割以激活S蛋白是调节宿主趋向性和致病性的另一个关键因素。比如,与MERS-CoV相关的蝙蝠冠状病毒HKU4进入人细胞需要加入外源胰蛋白酶,这表明这种蝙蝠冠状病毒的S蛋白的蛋白水解激活并没有在人细胞中发生。随后的研究提示着在S1/S2边界附近存在的聚糖是HKU4 S蛋白缺乏蛋白水解激活作用的原因,并且移除这种聚糖可增强HKU4 S假病毒进入人细胞的能力。
可通过弗林蛋白酶样蛋白酶加工的多碱性切割位点(polybasic cleavage site,即含有多个精氨酸残基的切割位点,其中精氨酸是碱性氨基酸)的存在是几种高致病性禽流感病毒和致病性新城疫病毒的典型特征。令人关注的是,SARS-CoV-2 S蛋白在S1/S2边界具有弗林蛋白酶切割位点,这个切割位点在生物合成过程中被加工。弗林蛋白酶切割位点的存在使SARS-CoV-2 S蛋白与SARS-CoV S蛋白和SARSr-CoV S蛋白区分开,这是因为后二者在S1/S2边界具有单碱性切割位点(monobasic cleavage site),这个切割位点在进入靶细胞时被加工。Veesler团队推测,相对于SARS-CoV,弗林蛋白酶样蛋白酶几乎无处不在的表达可能参与扩大SARS-CoV-2的宿主细胞和组织趋向性,以及增加它的传播性和/或改变它的致病性。
Veesler团队以前已提出冠状病毒使用构象掩蔽(conformational masking)和聚糖屏蔽(glycan shielding)来限制被感染宿主的免疫反应识别。如今,他们发现与SARS-CoV S蛋白和MERS-CoV S蛋白相类似的是,SARS-CoV-2 S蛋白三聚体以三种不同的构象状态存在,这是由S蛋白的结构域B在这种三聚体顶点处打开引起的。这些结构变化对于这三种病毒的受体结合是必需的,并导致融合构象变化的启动。
相比之下,对于其他四种感染人类的冠状病毒:HCoV-NL63、HCoV-OC43、HCoV-HKU1和HCoV-229E,仅检测到了封闭的S蛋白三聚体。鉴于已知HCoV-NL63和HCoV-229E通过结构域B结合蛋白受体,因此它们的S蛋白三聚体也有望打开,以暴露它们的被掩埋在封闭的S蛋白三聚体中的不同原聚体(protomer)之间界面上的受体结合基序。不论宿主受体的性质如何,也不论受体结合结构域的位置如何,移除三聚体S1冠状结构对于所有冠状病毒来说都是必要的,以允许大规模S2构象变化,从而导致病毒膜和宿主膜融合。总体而言,这些数据强调在高致病性人冠状病毒中发现的S蛋白三聚体似乎以部分打开的状态存在,而在与普通感冒相关的人冠状病毒中它们大体上保持封闭状态。基于上述将SARS-CoV与人ACE2的结合亲和力与不同物种中的传播率、病毒复制和疾病严重程度相关联在一起的数据,Veesler团队猜测最具致病性的冠状病毒会表现出S蛋白三聚体自发地采取封闭和开放的构象,就像SARS-CoV-2,SARS-CoV和MERS-CoV中的那样。
SARS-CoV-2 S蛋白和SARS-CoV S蛋白之间惊人的结构相似性和序列保守性突显了这两种通过识别人ACE2进入靶细胞的冠状病毒之间的密切关系。在这项新的研究中,Veesler团队发现SARS-CoV-2 S蛋白引发的多克隆抗体反应强效地中和SARS-CoV-2 S蛋白介导的细胞进入,从而进一步增强了这种相似性。
他们推测这些抗体中的大多数都靶向高度保守的S2亚基(包括融合肽区域),理由在于:SARS-CoV-2和SARS-CoV S2亚基的结构类似性;几种针对结构域B的抗体缺乏交叉反应性;之前的研究已发现来自SARS-CoV感染者的血清靶向这个区域。他们注意到,迄今为止分离出的大多数SARS-CoV中和抗体都靶向结构域B,其中的一些中和抗体识别受体结合基序并阻止受体结合。鉴于SARS-CoV-2和SARS-CoV结构域具有75%的氨基酸序列一致性(sequence identity),因此在未来有必要进一步评估这些抗体是否能够中和这种新出现的冠状病毒。
这些发现还表明,在使用S蛋白胞外结构域三聚体的血清学研究中,可能很难将SARS-CoV-2的暴露与其他SARSr-CoV的暴露区分开,因此将需要设计特定的检测方法。这些结果提供了一个结构框架以识别S蛋白中保守性的和可访问的表位,这将支持正在进行的疫苗设计工作。最后,在动物宿主中循环的病毒的多样性和防止病毒中和逃逸突变的可能出现来看,多克隆抗体反应的诱导可能是关键。(生物谷 Bioon.com)
参考资料:
Alexandra C. Walls et al. Structure, function and antigenicity of the SARS-CoV-2 spike glycoprotein. Cell, 2020, doi:10.1016/j.cell.2020.02.058.
SARS-CoV于2002年在中国广东省出现,并通过航空旅行路线传播到五大洲,感染8098人,造成774人死亡。2012年,MERS-CoV出现在阿拉伯半岛,并传播到27个国家,共感染约2494人,并夺走了858人的生命。如今,它仍然是阿拉伯半岛的一个主要的公共卫生问题。2019年12月在中国湖北省武汉市发现了一种以前未知的冠状病毒SARS-CoV-2,并于2020年1月对它进行了分离和测序。SARS-CoV-2与正在进行的非典型肺炎(Covid-2019)有关,截至2020年2月15日,它已影响29个国家的80000多人,并杀死了2700多人。2020年1月30日,世界卫生组织(WHO)宣布SARS-CoV-2疫情是国际关注的突发公共卫生事件。
MERS-CoV被认为起源于蝙蝠,但促进它溢出到人类的中间宿主是单峰骆驼。SARS-CoV和SARS-CoV-2彼此密切相关,都起源于蝙蝠,因此蝙蝠最有可能是这两种病毒的天然宿主。尽管果子狸已被公认是在蝙蝠和人类之间传播人畜共患病病原体SARS-CoV的中间宿主,但是SARS-CoV-2的中间宿主仍然未知。
冠状病毒在人类中多次溢出以及在蝙蝠中检测到许多冠状病毒,包括许多SARS相关冠状病毒(SARS-related coronavirus, SARSr-CoV),这提示着未来的人畜共患病传播事件可能会继续发生。除高致病性的属于β-冠状病毒属的人畜共患病病原体SARS-CoV、MERS-CoV和SARS-CoV-2之外,四种低致病性冠状病毒是人类特有的:HCoV-OC43、HCoV-HKU1、HCoV-NL63和HCoV-229E。迄今为止,尚未批准针对任何感染人类的冠状病毒的药物或疫苗。
冠状病毒进入宿主细胞是由跨膜刺突(S)糖蛋白(下称S蛋白)介导的,其中S蛋白形成从病毒表面突出的同型三聚体。S蛋白包含两个功能性亚基S1和S2,其中S1负责与宿主细胞受体结合,S2亚基负责病毒膜和细胞膜融合。对于许多冠状病毒而言,S蛋白在S1和S2亚基之间的边界处受到切割,而S1和S2亚基在融合前的构象中保持非共价结合。位于远端的S1亚基包含受体结合结构域,并有助于稳定包含融合装置(fusion machinery)的膜锚定S2亚基的融合前状态。对于所有的冠状病毒而言,S蛋白会在紧邻融合肽上游的所谓S2'位点被宿主蛋白酶进一步切割。有人已经提出这种进一步切割通过广泛的不可逆的构象变化激活S蛋白以进行膜融合。由此可知,冠状病毒进入易感细胞是一种复杂的过程,需要S蛋白的受体结合和蛋白水解过程协同作用以促进病毒-细胞融合。
不同的冠状病毒使用S1亚基内的不同结构域来识别各种附着受体和进入受体,这取决于冠状病毒种类。地方性人类冠状病毒HCoV-OC43和HCoV-HKU1通过S蛋白的结构域A(下称结构域A)附着到位于宿主细胞表面的糖蛋白和糖脂上的5-N-乙酰基-9-O-乙酰基唾液酸苷,从而使得它们能够进入易感细胞。然而,MERS-CoV的S蛋白使用结构域A来识别非乙酰化唾液苷附着受体,这可能会促进S蛋白的结构域B(下称结构域B)随后与一种称为二肽基结合肽酶4的进入受体结合。SARS-CoV和几种SARSr-CoV通过结构域B与血管紧张素转化酶2(ACE2)直接相互作用而进入靶细胞。
由于冠状病毒S蛋白暴露于病毒表面并介导病毒进入宿主细胞,因此它是感染后中和抗体的主要靶标,也是药物开发和疫苗设计的重点。S蛋白三聚体受到N-连接聚糖的广泛修饰,这对于它们的正确折叠和调节宿主蛋白酶和中和抗体的可接触性至关重要。美国华盛顿大学医学院生物化学系的David Veesler博士及其团队之前描述了从SARS-CoV或MERS-CoV感染者的罕见记忆B细胞中分离出强效的与SARS-CoV或MERS-CoV的S蛋白结合在一起的人类中和抗体,这就为竞争性抑制结构域B附着到宿主受体上的机制提供了分子水平上的信息(Cell, 2019, doi:10.1016/j.cell.2018.12.028)。作为这种针对SARS-CoV S蛋白的人类中和抗体,抗SARS-CoV抗体S230还可在功能上模拟受体附着和通过一种揭示这种冠状病毒膜融合激活独特性质的分子棘轮机制(molecular ratcheting mechanism)促进病毒刺突融合构象重排。

图片来自Cell, 2020, doi:10.1016/j.cell.2020.02.058。
在一项新的研究中,Veesler团队报道人ACE2可调节SARS-CoV-2 S蛋白介导的细胞进入,从而确定它是这种新出现的冠状病毒的功能性受体。SARS-CoV-2 S蛋白的结构域B与人ACE2结合的亲和力与来自与2002-2003年SARS疫情相关的SARS-CoV分离株的S蛋白的结构域B相当,这表明SARS-CoV-2 S蛋白的结构域B与人ACE2具有较高的结合亲和力。与人ACE2的紧密结合可以部分解释SARS-CoV-2在人类中的有效传播,就像SARS-CoV的情况一样。相关研究结果以论文手稿的形式在线发表在Cell期刊上,论文标题为“Structure, function and antigenicity of the SARS-CoV-2 spike glycoprotein”。
他们鉴定出在SARS-CoV-2 S蛋白的S1/S2亚基边界存在意料之外的弗林蛋白酶(furin)切割位点,这个位点在S蛋白的生物合成过程中被切割,这种新特征可将这种冠状病毒与SARS-CoV和SARSr-CoV区分开来。正如针对一些高致病性禽流感病毒和致病性新城疫病毒的报道那样,移除这种切割基序会适度影响SARS-CoV-2 S蛋白介导的VeroE6或BHK细胞进入,但是这可能有助于扩大这种冠状病毒的宿主趋向性。
他们解析出SARS-CoV-2 S蛋白胞外结构域三聚体的低温电镜结构,并揭示它具有多个结构域B构象,这使人想起了先前有关SARS-CoV S蛋白和MERS-CoV S蛋白的报道。他们证实SARS-CoV S蛋白小鼠多克隆血清有效抑制SARS-CoV-2 S假病毒进入靶细胞。这些结果为设计可广泛预防SARS-CoV-2、SARS-CoV和SARS-CoV的疫苗铺平了道路。
受体识别是病毒感染的第一步,也是宿主细胞和组织趋向性的关键决定因素。有人已提出SARS-CoV S蛋白与人ACE2之间的结合亲和力增强与人类中的病毒传播性和疾病严重性增加相关。确实,来自2002-2003年SARS疫情的三个阶段的SARS-CoV分离株在人与人之间的传播效率和致病性方面要比与2003-2004年仅导致少量病例的SARS疫情再出现相关的分离株更高,这与它们与人ACE2的结合亲和力相一致。而且,与不同动物物种的ACE2结合的能力似乎反映了宿主对SARS-CoV感染的易感性,并促进了这种病毒从动物向人类的跳跃。在这项新的研究中,这些研究人员报道SARS-CoV-2使用人ACE2作为进入受体,它结合人ACE2的亲和力与2002-2003 SARS-CoV分离株相似,这提示着它能够在人类中有效传播,这与迄今为止报道的大量SARS-CoV-2人际传播事件相一致。
除了S蛋白与宿主细胞受体结合外,宿主蛋白酶通过在S蛋白的S1/S2和S2'位点进行切割以激活S蛋白是调节宿主趋向性和致病性的另一个关键因素。比如,与MERS-CoV相关的蝙蝠冠状病毒HKU4进入人细胞需要加入外源胰蛋白酶,这表明这种蝙蝠冠状病毒的S蛋白的蛋白水解激活并没有在人细胞中发生。随后的研究提示着在S1/S2边界附近存在的聚糖是HKU4 S蛋白缺乏蛋白水解激活作用的原因,并且移除这种聚糖可增强HKU4 S假病毒进入人细胞的能力。
可通过弗林蛋白酶样蛋白酶加工的多碱性切割位点(polybasic cleavage site,即含有多个精氨酸残基的切割位点,其中精氨酸是碱性氨基酸)的存在是几种高致病性禽流感病毒和致病性新城疫病毒的典型特征。令人关注的是,SARS-CoV-2 S蛋白在S1/S2边界具有弗林蛋白酶切割位点,这个切割位点在生物合成过程中被加工。弗林蛋白酶切割位点的存在使SARS-CoV-2 S蛋白与SARS-CoV S蛋白和SARSr-CoV S蛋白区分开,这是因为后二者在S1/S2边界具有单碱性切割位点(monobasic cleavage site),这个切割位点在进入靶细胞时被加工。Veesler团队推测,相对于SARS-CoV,弗林蛋白酶样蛋白酶几乎无处不在的表达可能参与扩大SARS-CoV-2的宿主细胞和组织趋向性,以及增加它的传播性和/或改变它的致病性。
Veesler团队以前已提出冠状病毒使用构象掩蔽(conformational masking)和聚糖屏蔽(glycan shielding)来限制被感染宿主的免疫反应识别。如今,他们发现与SARS-CoV S蛋白和MERS-CoV S蛋白相类似的是,SARS-CoV-2 S蛋白三聚体以三种不同的构象状态存在,这是由S蛋白的结构域B在这种三聚体顶点处打开引起的。这些结构变化对于这三种病毒的受体结合是必需的,并导致融合构象变化的启动。
相比之下,对于其他四种感染人类的冠状病毒:HCoV-NL63、HCoV-OC43、HCoV-HKU1和HCoV-229E,仅检测到了封闭的S蛋白三聚体。鉴于已知HCoV-NL63和HCoV-229E通过结构域B结合蛋白受体,因此它们的S蛋白三聚体也有望打开,以暴露它们的被掩埋在封闭的S蛋白三聚体中的不同原聚体(protomer)之间界面上的受体结合基序。不论宿主受体的性质如何,也不论受体结合结构域的位置如何,移除三聚体S1冠状结构对于所有冠状病毒来说都是必要的,以允许大规模S2构象变化,从而导致病毒膜和宿主膜融合。总体而言,这些数据强调在高致病性人冠状病毒中发现的S蛋白三聚体似乎以部分打开的状态存在,而在与普通感冒相关的人冠状病毒中它们大体上保持封闭状态。基于上述将SARS-CoV与人ACE2的结合亲和力与不同物种中的传播率、病毒复制和疾病严重程度相关联在一起的数据,Veesler团队猜测最具致病性的冠状病毒会表现出S蛋白三聚体自发地采取封闭和开放的构象,就像SARS-CoV-2,SARS-CoV和MERS-CoV中的那样。
SARS-CoV-2 S蛋白和SARS-CoV S蛋白之间惊人的结构相似性和序列保守性突显了这两种通过识别人ACE2进入靶细胞的冠状病毒之间的密切关系。在这项新的研究中,Veesler团队发现SARS-CoV-2 S蛋白引发的多克隆抗体反应强效地中和SARS-CoV-2 S蛋白介导的细胞进入,从而进一步增强了这种相似性。
他们推测这些抗体中的大多数都靶向高度保守的S2亚基(包括融合肽区域),理由在于:SARS-CoV-2和SARS-CoV S2亚基的结构类似性;几种针对结构域B的抗体缺乏交叉反应性;之前的研究已发现来自SARS-CoV感染者的血清靶向这个区域。他们注意到,迄今为止分离出的大多数SARS-CoV中和抗体都靶向结构域B,其中的一些中和抗体识别受体结合基序并阻止受体结合。鉴于SARS-CoV-2和SARS-CoV结构域具有75%的氨基酸序列一致性(sequence identity),因此在未来有必要进一步评估这些抗体是否能够中和这种新出现的冠状病毒。
这些发现还表明,在使用S蛋白胞外结构域三聚体的血清学研究中,可能很难将SARS-CoV-2的暴露与其他SARSr-CoV的暴露区分开,因此将需要设计特定的检测方法。这些结果提供了一个结构框架以识别S蛋白中保守性的和可访问的表位,这将支持正在进行的疫苗设计工作。最后,在动物宿主中循环的病毒的多样性和防止病毒中和逃逸突变的可能出现来看,多克隆抗体反应的诱导可能是关键。(生物谷 Bioon.com)
参考资料:
Alexandra C. Walls et al. Structure, function and antigenicity of the SARS-CoV-2 spike glycoprotein. Cell, 2020, doi:10.1016/j.cell.2020.02.058.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


