Nature:从地球不同环境中发现351种新的巨大噬菌体,它们模糊了病毒和细菌之间的界线
来源:本站原创 2020-02-15 20:47
2020年2月15日讯/生物谷BIOON/---在一项新的研究中,来自美国加州大学伯克利分校、科罗拉多州立大学、斯坦福大学、美国能源部联合基因组研究所、匹兹堡大学医学院、中国中山大学、南非开普敦大学、法国国家科学研究中心、英国伦敦大学学院、澳大利亚墨尔本大学、丹麦技术大学、日本原子能机构和加拿大多伦多大学的研究人员发现了数百种异常大的、能杀死细菌的病毒,它们
2020年2月15日讯/生物谷BIOON/---在一项新的研究中,来自美国加州大学伯克利分校、科罗拉多州立大学、斯坦福大学、美国能源部联合基因组研究所、匹兹堡大学医学院、中国中山大学、南非开普敦大学、法国国家科学研究中心、英国伦敦大学学院、澳大利亚墨尔本大学、丹麦技术大学、日本原子能机构和加拿大多伦多大学的研究人员发现了数百种异常大的、能杀死细菌的病毒,它们通常具有与活的有机体相关的功能,这模糊了活的细菌与病毒之间的界线。相关研究结果于2020年2月12日在线发表在Nature期刊上,论文标题为“Clades of huge phages from across Earth’s ecosystems”。论文通讯作者为加州大学伯克利分校的Jill Banfield教授。论文第一作者为加州大学伯克利分校研究生Basem Al-Shayeb和研究助理Rohan Sachdeva。
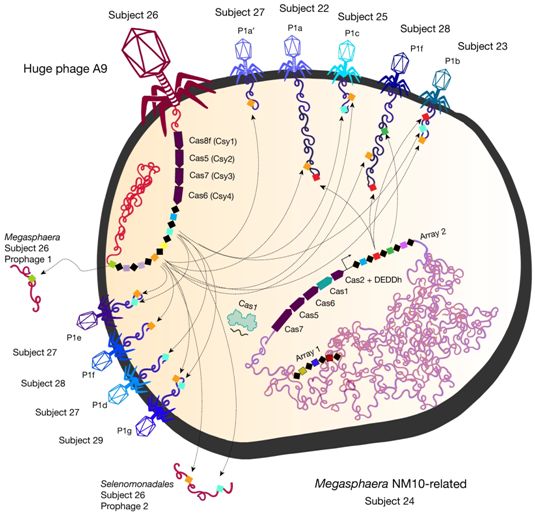
这些病毒被称为噬菌体,这是因为它们吞噬细菌---细菌的大小和复杂性被认为是生命的典型特征。它们携带着通常在细菌中发现的许多基因,并使用这些基因抵抗它们的细菌宿主。
这些研究人员通过搜索庞大的DNA数据库来发现这些巨大噬菌体(huge phage,也称为megaphage),这些DNA数据库是从将近30种不同的地球环境---从早产儿和孕妇的肠道到西藏温泉、病房、海洋、湖泊和深层地下---中产生的。他们总共鉴定出351种不同的巨大噬菌体,它们的基因组比吞噬单细胞细菌的病毒的平均基因组大4倍或更多倍。在它们当中,存在迄今为止发现的一种最大的噬菌体:它的基因组长735000个碱基(即735kb),比噬菌体的平均基因组大近15倍。这个已知最大的噬菌体基因组比许多细菌的基因组大得多。
Banfield说,“我们正在探索地球的微生物组,有时会出现意想不到的事情。一方面,这些巨大噬菌体弥合了无生命的噬菌体与细菌和古生菌之间的鸿沟。似乎确实存在一种成功的生存策略:它们被我们认为是传统病毒和传统生物体之间的杂交体。”
具有讽刺意味的是,在这些巨大噬菌体所携带的DNA中,存在细菌用来对抗病毒的CRISPR系统的一部分。很有可能发生的情形是,一旦这些噬菌体将它们的DNA注入细菌,这种病毒CRISPR系统就会增强宿主细菌的CRISPR系统,很可能主要是让细菌CRISPR系统靶向其他病毒。
Al-Shayeb说,“令人着迷的是,这些噬菌体如何重新利用一种我们认为是属于细菌或古生菌的系统,以使得它们自身受益于它们与噬菌体的竞争,从而触发了不同病毒之间的战争。”
新的Cas蛋白
这些巨大噬菌体中的一种也能够制造一种类似于Cas9蛋白的蛋白,Cas9是由加州大学伯克利分校的Jennifer Doudna和她的欧洲同事Emmanuelle Charpentier改进的用于基因编辑的革命性工具CRISPR-Cas9的一部分。这些研究人员将这种微小的蛋白称为CasØ,这是因为希腊字母Ø或phi通常被用来表示噬菌体。
Sachdeva说,“在这些巨大噬菌体中,寻找用于基因组工程的新工具的潜力很大。我们发现的许多基因都是未知的,它们没有假定的功能,可能是工业、医学或农业应用中新蛋白的来源。”
除了为噬菌体和细菌之间的持续战争提供新的见解之外,这些新的发现还对人类疾病产生影响。通常,病毒在细胞之间传递基因,包括赋予抗生素抗性的基因。鉴于噬菌体存在于细菌和古生菌生活的任何地方,包括人类肠道微生物组,因此它们可以将有害的基因带入定植在人体内的细菌中。
Banfield说,“某些疾病是由噬菌体间接引起的,这是因为噬菌体会传递与发病机理和抗生素抗性有关的基因。噬菌体基因组越大,传递这些基因的能力就越大,并且将不需要的基因传递给人体微生物组中细菌的可能性就越高。”
对地球生物群落进行测序
15多年来,Banfield一直在探索地球上不同环境中的细菌、古生菌和噬菌体的多样性。她的方法就是对样本中的所有DNA进行测序,然后将测序出的所有序列片段拼凑在一起,以组装出基因组草图,或者在某些情况下,将从未见过的微生物的基因组完全整理好。在这个过程中,她发现许多新的微生物具有极小基因组,似乎不足以维持独立的生活。相反,它们似乎依赖其他细菌和古生菌才能生存下来。
一年前,她已报道一些最大的噬菌体,即一群她称为Lak的噬菌体,可以在我们的肠道和口腔中找到,在那里,它们吞噬肠道和唾液中的细菌。
这篇新的论文是对Banfield积累的所有宏基因组序列以及全球研究合作者提供的新的宏基因组中的巨大噬菌体进行了更彻底的搜索。这些宏基因组来自狒狒、猪、阿拉斯加驼鹿、土壤样本、海洋、河流、湖泊和地下水(包括孟加拉国人一直饮用的被砷污染的地下水)。
这些研究人员鉴定出351个巨大噬菌体基因组的长度超过200kb,是平均噬菌体基因组长度50 kb的四倍。他们能够确定175个巨大噬菌体基因组的确切长度,剩下的巨大噬菌体基因组的长度可能大于200kb。其中的一个完整的巨大噬菌体基因组长度为735kb,如今是已知最大的噬菌体基因组。
尽管这些巨大噬菌体中的大多数基因编码未知的蛋白,但是这些研究人员仍能够在它们中鉴定出编码对核糖体至关重要的蛋白的基因。在细胞中,核糖体是将信使RNA(mRNA)转化为蛋白的蛋白制造工厂。核糖体主要由核糖体RNA(rRNA)和蛋白(也称为核糖体蛋白)组成。这些基因通常并不在病毒中发现,仅在细菌或古生菌中发现。
这些研究人员在这些巨大噬菌体中发现了许多编码转移RNA(tRNA)的基因,tRNA携带氨基酸到核糖体中使得所携带的氨基酸整合到新的蛋白中;编码加载和调节tRNA的蛋白的基因;编码启动翻译的蛋白和甚至核糖体本身一部分(指的是rRNA或核糖体蛋白)的基因。
Sachdeva说,“通常而言,将生命与非生命区分开来的是拥有核糖体和进行翻译的能力;这是区分病毒和细菌、非生命与生命的主要特征之一。一些大型噬菌体具有很多这种翻译复合物(即核糖体),因此它们使得这种区分界线有些模糊。”
巨大噬菌体可能使用这些基因来重定向核糖体,使得它们以牺牲细菌蛋白制造为代价,更多地制造它们自身的蛋白。一些巨大噬菌体也有替代的遗传密码,即编码特定氨基酸的核酸三联体,这可能会混淆解码RNA的细菌核糖体。一些巨大的噬菌体也有替代的遗传密码,即核酸三联体编码一种特定的氨基酸,这可能迷惑了翻译mRNA的细菌核糖体。
此外,一些新发现的巨大噬菌体携带了在许多种细菌CRISPR系统中发现的Cas蛋白变体的编码基因,比如Cas9、Cas12、CasX和CasY家族。CasØ是Cas12家族的一种变体。一些巨大噬菌体也具有CRISPR阵列,它们通常是细菌基因组中储存病毒DNA片段的区域,所储存的病毒DNA片段作为参照序列,使得细菌能够识别再次入侵的相同噬菌体并动员它们的Cas蛋白靶向和切割再次入侵的噬菌体。
Banfield说,“我们得出的高水平结论是,具有较大基因组的巨大噬菌体在整个地球生态系统中都非常突出,它们并不是某个生态系统独有的。具有较大基因组的巨大噬菌体意味着它们是具有悠久的较大基因组历史的谱系。拥有较大基因组是一种成功的生存策略,而我们对此知之甚少。”
这些研究人员将351种巨大噬菌体分为10个新的进化枝(clade),以这篇论文的共同作者的语言中表示“大”的词语命名:Mahaphage(梵语)、Kabirphage、Dakhmphage、Jabbarphage(阿拉伯语);Kyodaiphage(日语);Biggiephage(澳大利亚英语),Whopperphage(美国英语);Judaphage(中文),Enormephage(法语)和Kaempephage(丹麦语)。(生物谷 Bioon.com)
参考资料:
1.Basem Al-Shayeb et al. Clades of huge phages from across Earth’s ecosystems. Nature, 2020, doi:10.1038/s41586-020-2007-4.
2.Huge bacteria-eating viruses close gap between life and non-life
https://phys.org/news/2020-02-huge-bacteria-eating-viruses-gap-life.html

图片来自Nature, 2020, doi:10.1038/s41586-020-2007-4。
这些病毒被称为噬菌体,这是因为它们吞噬细菌---细菌的大小和复杂性被认为是生命的典型特征。它们携带着通常在细菌中发现的许多基因,并使用这些基因抵抗它们的细菌宿主。
这些研究人员通过搜索庞大的DNA数据库来发现这些巨大噬菌体(huge phage,也称为megaphage),这些DNA数据库是从将近30种不同的地球环境---从早产儿和孕妇的肠道到西藏温泉、病房、海洋、湖泊和深层地下---中产生的。他们总共鉴定出351种不同的巨大噬菌体,它们的基因组比吞噬单细胞细菌的病毒的平均基因组大4倍或更多倍。在它们当中,存在迄今为止发现的一种最大的噬菌体:它的基因组长735000个碱基(即735kb),比噬菌体的平均基因组大近15倍。这个已知最大的噬菌体基因组比许多细菌的基因组大得多。
Banfield说,“我们正在探索地球的微生物组,有时会出现意想不到的事情。一方面,这些巨大噬菌体弥合了无生命的噬菌体与细菌和古生菌之间的鸿沟。似乎确实存在一种成功的生存策略:它们被我们认为是传统病毒和传统生物体之间的杂交体。”
具有讽刺意味的是,在这些巨大噬菌体所携带的DNA中,存在细菌用来对抗病毒的CRISPR系统的一部分。很有可能发生的情形是,一旦这些噬菌体将它们的DNA注入细菌,这种病毒CRISPR系统就会增强宿主细菌的CRISPR系统,很可能主要是让细菌CRISPR系统靶向其他病毒。
Al-Shayeb说,“令人着迷的是,这些噬菌体如何重新利用一种我们认为是属于细菌或古生菌的系统,以使得它们自身受益于它们与噬菌体的竞争,从而触发了不同病毒之间的战争。”
新的Cas蛋白
这些巨大噬菌体中的一种也能够制造一种类似于Cas9蛋白的蛋白,Cas9是由加州大学伯克利分校的Jennifer Doudna和她的欧洲同事Emmanuelle Charpentier改进的用于基因编辑的革命性工具CRISPR-Cas9的一部分。这些研究人员将这种微小的蛋白称为CasØ,这是因为希腊字母Ø或phi通常被用来表示噬菌体。
Sachdeva说,“在这些巨大噬菌体中,寻找用于基因组工程的新工具的潜力很大。我们发现的许多基因都是未知的,它们没有假定的功能,可能是工业、医学或农业应用中新蛋白的来源。”
除了为噬菌体和细菌之间的持续战争提供新的见解之外,这些新的发现还对人类疾病产生影响。通常,病毒在细胞之间传递基因,包括赋予抗生素抗性的基因。鉴于噬菌体存在于细菌和古生菌生活的任何地方,包括人类肠道微生物组,因此它们可以将有害的基因带入定植在人体内的细菌中。
Banfield说,“某些疾病是由噬菌体间接引起的,这是因为噬菌体会传递与发病机理和抗生素抗性有关的基因。噬菌体基因组越大,传递这些基因的能力就越大,并且将不需要的基因传递给人体微生物组中细菌的可能性就越高。”
对地球生物群落进行测序
15多年来,Banfield一直在探索地球上不同环境中的细菌、古生菌和噬菌体的多样性。她的方法就是对样本中的所有DNA进行测序,然后将测序出的所有序列片段拼凑在一起,以组装出基因组草图,或者在某些情况下,将从未见过的微生物的基因组完全整理好。在这个过程中,她发现许多新的微生物具有极小基因组,似乎不足以维持独立的生活。相反,它们似乎依赖其他细菌和古生菌才能生存下来。
一年前,她已报道一些最大的噬菌体,即一群她称为Lak的噬菌体,可以在我们的肠道和口腔中找到,在那里,它们吞噬肠道和唾液中的细菌。
这篇新的论文是对Banfield积累的所有宏基因组序列以及全球研究合作者提供的新的宏基因组中的巨大噬菌体进行了更彻底的搜索。这些宏基因组来自狒狒、猪、阿拉斯加驼鹿、土壤样本、海洋、河流、湖泊和地下水(包括孟加拉国人一直饮用的被砷污染的地下水)。
这些研究人员鉴定出351个巨大噬菌体基因组的长度超过200kb,是平均噬菌体基因组长度50 kb的四倍。他们能够确定175个巨大噬菌体基因组的确切长度,剩下的巨大噬菌体基因组的长度可能大于200kb。其中的一个完整的巨大噬菌体基因组长度为735kb,如今是已知最大的噬菌体基因组。
尽管这些巨大噬菌体中的大多数基因编码未知的蛋白,但是这些研究人员仍能够在它们中鉴定出编码对核糖体至关重要的蛋白的基因。在细胞中,核糖体是将信使RNA(mRNA)转化为蛋白的蛋白制造工厂。核糖体主要由核糖体RNA(rRNA)和蛋白(也称为核糖体蛋白)组成。这些基因通常并不在病毒中发现,仅在细菌或古生菌中发现。
这些研究人员在这些巨大噬菌体中发现了许多编码转移RNA(tRNA)的基因,tRNA携带氨基酸到核糖体中使得所携带的氨基酸整合到新的蛋白中;编码加载和调节tRNA的蛋白的基因;编码启动翻译的蛋白和甚至核糖体本身一部分(指的是rRNA或核糖体蛋白)的基因。
Sachdeva说,“通常而言,将生命与非生命区分开来的是拥有核糖体和进行翻译的能力;这是区分病毒和细菌、非生命与生命的主要特征之一。一些大型噬菌体具有很多这种翻译复合物(即核糖体),因此它们使得这种区分界线有些模糊。”
巨大噬菌体可能使用这些基因来重定向核糖体,使得它们以牺牲细菌蛋白制造为代价,更多地制造它们自身的蛋白。一些巨大噬菌体也有替代的遗传密码,即编码特定氨基酸的核酸三联体,这可能会混淆解码RNA的细菌核糖体。一些巨大的噬菌体也有替代的遗传密码,即核酸三联体编码一种特定的氨基酸,这可能迷惑了翻译mRNA的细菌核糖体。
此外,一些新发现的巨大噬菌体携带了在许多种细菌CRISPR系统中发现的Cas蛋白变体的编码基因,比如Cas9、Cas12、CasX和CasY家族。CasØ是Cas12家族的一种变体。一些巨大噬菌体也具有CRISPR阵列,它们通常是细菌基因组中储存病毒DNA片段的区域,所储存的病毒DNA片段作为参照序列,使得细菌能够识别再次入侵的相同噬菌体并动员它们的Cas蛋白靶向和切割再次入侵的噬菌体。
Banfield说,“我们得出的高水平结论是,具有较大基因组的巨大噬菌体在整个地球生态系统中都非常突出,它们并不是某个生态系统独有的。具有较大基因组的巨大噬菌体意味着它们是具有悠久的较大基因组历史的谱系。拥有较大基因组是一种成功的生存策略,而我们对此知之甚少。”
这些研究人员将351种巨大噬菌体分为10个新的进化枝(clade),以这篇论文的共同作者的语言中表示“大”的词语命名:Mahaphage(梵语)、Kabirphage、Dakhmphage、Jabbarphage(阿拉伯语);Kyodaiphage(日语);Biggiephage(澳大利亚英语),Whopperphage(美国英语);Judaphage(中文),Enormephage(法语)和Kaempephage(丹麦语)。(生物谷 Bioon.com)
参考资料:
1.Basem Al-Shayeb et al. Clades of huge phages from across Earth’s ecosystems. Nature, 2020, doi:10.1038/s41586-020-2007-4.
2.Huge bacteria-eating viruses close gap between life and non-life
https://phys.org/news/2020-02-huge-bacteria-eating-viruses-gap-life.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


