EZH2抑制剂!Epizyme表观遗传学药物Tazverik获美国FDA批准,上皮样肉瘤(ES)治疗药物!
来源:本站原创 2020-01-24 11:19
2020年01月24日讯 /生物谷BIOON/ --Epizyme是一家致力于开发新型表观遗传学药物的生物制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已加速批准表观遗传学药物Tazverik(tazemetostat),用于治疗16岁及以上、不符合完全切除条件的转移性或局部晚期上皮样肉瘤(ES)儿科和成人患者。该药是一种口服、首创EZH2抑制剂

2020年01月24日讯 /生物谷BIOON/ --Epizyme是一家致力于开发新型表观遗传学药物的生物制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已加速批准表观遗传学药物Tazverik(tazemetostat),用于治疗16岁及以上、不符合完全切除条件的转移性或局部晚期上皮样肉瘤(ES)儿科和成人患者。该药是一种口服、首创EZH2抑制剂,2019年12月获得了FDA肿瘤药物顾问委员会(ODAC)全票(11-0)通过的支持。此次加速批准,基于一项II期临床试验中的总缓解率(ORR)和缓解持续时间(DOR)数据。该适应症的持续批准,将取决于验证性试验中对临床益处的验证和描述。
值得一提的是,Tazverik是获美国FDA批准的第一个也是唯一一个EZH2抑制剂,也是该机构批准专门针对ES患者的第一个也是唯一一个疗法。该药的加速批准,对ES患者群体来说是一个里程碑式的事件。目前,ES患者的治疗方案非常有限,当前使用的治疗方法复发率和毒性都很高。来自II期临床的数据,支持了Tazverik为ES患者提供有临床意义的持久缓解潜力。
此次批准,基于一项正在进行的II期研究中ES队列62例患者的数据。该队列数据已在2019年美国临床肿瘤学会(ASCO)年会上公布。结果显示,tazemetostat治疗获得了临床意义的、持久的缓解,并且安全性和耐受性良好。这62例患者中,有24例为初治患者,38例为复发性和/或难治性患者。研究中,患者接受800mg剂量Tazverik治疗,每日2次,直至疾病进展或毒性达到不可接受的水平。肿瘤缓解评估每8周进行一次。
中位随访14个月(0.4-31)的数据显示,总缓解率(ORR)为15%,其中完全缓解率(CR)为1.6%,部分缓解率(PR)为13%。病情缓解的9例患者中,有6例(67%)缓解持续时间在6个月或更长时间。研究中,服用Tazverik的患者最常见的副作用是疼痛、疲劳、恶心、食欲下降、呕吐和便秘。
目前,Epizyme公司正在开展一项全球性、随机、对照、验证性试验,评估Tazverik联合多柔比星(doxorubicin)、多柔比星联合安慰剂一线治疗ES的疗效。此外,Epizyme公司还将开展一些上市后活动,包括评估Tazverik对肝功能影响的临床药理学评估,以及CYP3A抑制剂和诱导剂对Tazverik的影响,以提示处方信息的各个方面。
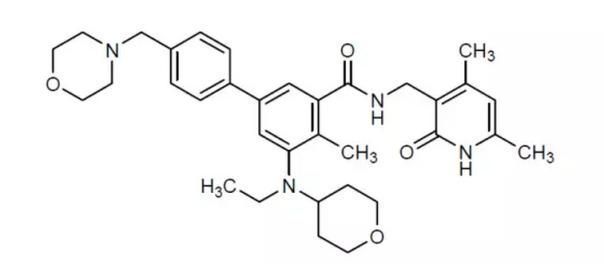
tazemetostat分子结构式(图片来源:Wikipedia)
Tazverik的活性药物成分tazemetostat是一种口服、强效、首创(first-in-class)、EZH2抑制剂。EZH2是一种组蛋白甲基转移酶,如被异常激活,将导致控制细胞增殖的基因失调,从而可引起非霍奇金淋巴瘤(NHL)及其他多种实体瘤细胞的无限制迅速生长。tazemetostat可通过抑制EZH2酶活性而发挥抗肿瘤作用。在临床研究中,tazemetostat在治疗早期就表现出了安全有效地缩小甚至消除肿瘤的能力。
目前,tazemetostat正被开发用于多种类型的血液系统恶性肿瘤(非霍奇金淋巴瘤:复发性或难治性弥漫性大B细胞淋巴瘤[DLBCL]、滤泡性淋巴瘤[FL])和基因定义的实体肿瘤(上皮样肉瘤、滑膜肉瘤、INI1阴性肿瘤、去势抵抗性前列腺癌、铂耐药实体瘤等)。
2019年12月,Epizyme公司向美国FDA提交了一份新药申请(NDA),寻求加速批准tazemetostat,用于先前已接受过至少2种系统疗法、携带或不携带EZH2激活突变、复发或难治性滤泡性淋巴瘤(FL)患者。来自II期临床研究的数据显示,在EZH2突变FL患者、野生型EZH2 FL患者中,tazemetostat治疗的总缓解率(ORR)分别为69%、35%,中位缓解持续时间(DOR)分别为11个月、13个月,中位无进展生存期(PFS)分别为14个月、11个月,2个组中位中生存期(OS)均未达到。该研究中,tazemetostat的安全性和耐受性良好。
目前,FL仍然是一种毁灭性的不治之症。如果获得批准,tazemetostat将为携带或不携带EZH2激活突变的FL患者群体带来一种新的治疗选择。在临床研究中观察到的持久缓解和良好的安全性,支持了tazemetostat为这类患者带来有意义改变的潜力。
Epizyme公司拥有tazemetostat在日本以外地区的全球开发和商业化权利。在日本,卫材拥有tazemetostat的开发和商业化权利,并拥有在亚洲其他地区的首次协商权。除了tazemetostat之外,Epizyme公司管线中还拥有多款表观遗传学药物,包括DOT1L抑制剂pinometostat、G9A抑制剂EZM8266、PRMT5抑制剂和其他小分子肿瘤学项目。此外,Epizyme还与多家制药公司达成了广泛合作,包括罗氏、葛兰素史克、勃林格殷格翰、新基、卫材等。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


