Science:解析出嗜热栖热菌V/A-ATP酶的三维结构
来源:本站原创 2019-08-27 15:38
2019年8月27日讯/生物谷BIOON/---细胞依赖于称为ATP合酶(ATP synthase)或ATP酶(ATPase)的蛋白复合物来满足它们的能量需求。三磷酸腺苷(ATP)分子为维持生命的大部分过程提供能量。在一项新的研究中,奥地利科学技术研究所的结构生物学者Leonid Sazanov和博士后研究员Long Zhou如今解析出V/A-ATP酶家族代表性成员的首个原子结构,填补了这些必不可
2019年8月27日讯/生物谷BIOON/---细胞依赖于称为ATP合酶(ATP synthase)或ATP酶(ATPase)的蛋白复合物来满足它们的能量需求。三磷酸腺苷(ATP)分子为维持生命的大部分过程提供能量。在一项新的研究中,奥地利科学技术研究所的结构生物学者Leonid Sazanov和博士后研究员Long Zhou如今解析出V/A-ATP酶家族代表性成员的首个原子结构,填补了这些必不可少的分子机器的进化树上的空白。利用最新的低温电镜(cryo-EM)方法获得的这些结果揭示了这种酶的结构类似于涡轮机或水磨机。相关研究结果发表在2019年8月23日的Science期刊上,论文标题为“Structure and conformational plasticity of the intact Thermus thermophilus V/A-type ATPase”。
旋转动力
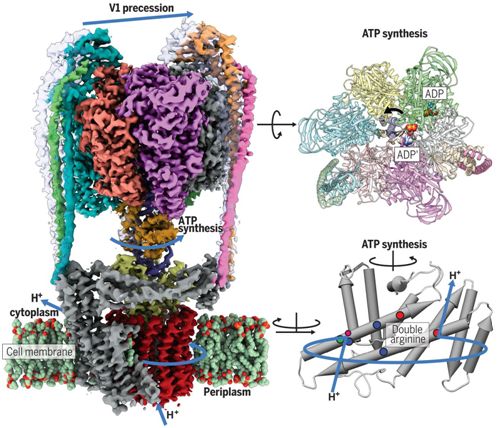
ATP合酶/ATP酶是大型膜蛋白复合物,它们具有相同的整体结构和旋转催化机制。这种蛋白质家族包括在线粒体(细胞的能量工厂)、叶绿体(在植物中进行光合作用的细胞器)和细菌中发现的F型ATP酶,叶绿体(在植物中进行光合作用的细胞器)和细菌;在真核生物(具有细胞核的高等生物)中发现的V型ATP酶;在古细菌(古老的微生物)和一些细菌中发现的A型ATP酶。
不同类型的ATP酶
F型ATP酶和A型ATP酶通常起着产生ATP的作用,这种ATP产生由跨膜的质子流动驱动。V型ATP酶通常起着相反的作用,使用ATP泵送质子。V型ATP酶和A型ATP酶在结构上相类似,与F型ATP酶不同,具有两个或三个外周茎部结构和位于结构域V1和V0之间的额外连接蛋白亚基。V型ATP酶很可能是从A型ATP酶进化而来的,由于这些相似性,A型ATP酶也被称为V/A-ATP酶。一些细菌,包括嗜热栖热菌(Thermus thermophilus)获得了A型ATP酶。Zhou纯化出嗜热栖热菌的V/A-ATP酶:ThV1Vo,并利用cryo-EM研究了这种酶。与F型ATP酶相反的是,人们之前仅确定了V型ATP酶的V1和Vo结构域的结构。因此,人们并不清楚V1如何与Vo结合在一起,而且也不了解这个完整的催化循环。
可塑性和竞争
Sazanov和Zhou利用cryo-EM解析出完整的ThV1Vo酶的总共5种结构,而不是一种结构。这些结构代表着这种酶的几种构象状态,它们的不同之处在于转子(rotor)在定子(stator)内部的位置。
ThV1Vo的整体构象可塑性表现为当从一种构象状态向另一种构象状态过渡时,V1结构在空间上的剧烈摆动。这是弯曲的中心转子的旋转和定子的刚度之间的机械竞争的结果。V1-Vo偶联在一起是通过轴与连接到c环(c-ring)的V型ATP酶特异性亚基之间的紧密结构匹配和静电匹配实现的。质子路径的可视化揭示了带电荷的蛋白残基的分布与F-ATP酶中的存在着显着差异,具有更严格的“检查点”来防止这种酶的“滑落”。
为何增添额外的复杂性?
不同于具有单个外周茎部结构的F-ATP酶,诸如ThV1Vo之类的A-ATP酶具有两个外周茎部结构,而真核生物V-ATP酶则具有三个。但是,在已非常大的蛋白组装物上增添额外的复杂性以及连接V1和Vo的额外亚基的优势是什么?F1/V1结构域具有三重对称性,因此定子在F1/V1内部每旋转120°就产生(或消耗)一个ATP分子。
Sazanov说:“在V/A -ATP酶中,这一步是一次性旋转120°,与此不同的是,在F-ATP合酶中,它分为几个子步骤。因此,ThV1Vo可能需要更大的可塑性,以便将V1结构域中的这些120°旋转步骤与Vo c12环中更小的每个c亚基步骤相关联在一起。在V-ATP酶中,这种额外的灵活性可能通过这些额外的外周茎部结构和连接亚基加以实现。我们解析出的新结构显示了这一点是如何实现的,这就为整个V-ATP酶家族提供了框架。”(生物谷 Bioon.com)
参考资料:
1.Long Zhou er al. Structure and conformational plasticity of the intact Thermus thermophilus V/A-type ATPase. Science, 2019, doi:10.1126/science.aaw9144.
2.Structure of protein nanoturbine revealed
https://phys.org/news/2019-08-protein-nanoturbine-revealed.html

图片来自Science, 2019, doi:10.1126/science.aaw9144。
旋转动力
ATP合酶/ATP酶是大型膜蛋白复合物,它们具有相同的整体结构和旋转催化机制。这种蛋白质家族包括在线粒体(细胞的能量工厂)、叶绿体(在植物中进行光合作用的细胞器)和细菌中发现的F型ATP酶,叶绿体(在植物中进行光合作用的细胞器)和细菌;在真核生物(具有细胞核的高等生物)中发现的V型ATP酶;在古细菌(古老的微生物)和一些细菌中发现的A型ATP酶。
不同类型的ATP酶
F型ATP酶和A型ATP酶通常起着产生ATP的作用,这种ATP产生由跨膜的质子流动驱动。V型ATP酶通常起着相反的作用,使用ATP泵送质子。V型ATP酶和A型ATP酶在结构上相类似,与F型ATP酶不同,具有两个或三个外周茎部结构和位于结构域V1和V0之间的额外连接蛋白亚基。V型ATP酶很可能是从A型ATP酶进化而来的,由于这些相似性,A型ATP酶也被称为V/A-ATP酶。一些细菌,包括嗜热栖热菌(Thermus thermophilus)获得了A型ATP酶。Zhou纯化出嗜热栖热菌的V/A-ATP酶:ThV1Vo,并利用cryo-EM研究了这种酶。与F型ATP酶相反的是,人们之前仅确定了V型ATP酶的V1和Vo结构域的结构。因此,人们并不清楚V1如何与Vo结合在一起,而且也不了解这个完整的催化循环。
可塑性和竞争
Sazanov和Zhou利用cryo-EM解析出完整的ThV1Vo酶的总共5种结构,而不是一种结构。这些结构代表着这种酶的几种构象状态,它们的不同之处在于转子(rotor)在定子(stator)内部的位置。
ThV1Vo的整体构象可塑性表现为当从一种构象状态向另一种构象状态过渡时,V1结构在空间上的剧烈摆动。这是弯曲的中心转子的旋转和定子的刚度之间的机械竞争的结果。V1-Vo偶联在一起是通过轴与连接到c环(c-ring)的V型ATP酶特异性亚基之间的紧密结构匹配和静电匹配实现的。质子路径的可视化揭示了带电荷的蛋白残基的分布与F-ATP酶中的存在着显着差异,具有更严格的“检查点”来防止这种酶的“滑落”。
为何增添额外的复杂性?
不同于具有单个外周茎部结构的F-ATP酶,诸如ThV1Vo之类的A-ATP酶具有两个外周茎部结构,而真核生物V-ATP酶则具有三个。但是,在已非常大的蛋白组装物上增添额外的复杂性以及连接V1和Vo的额外亚基的优势是什么?F1/V1结构域具有三重对称性,因此定子在F1/V1内部每旋转120°就产生(或消耗)一个ATP分子。
Sazanov说:“在V/A -ATP酶中,这一步是一次性旋转120°,与此不同的是,在F-ATP合酶中,它分为几个子步骤。因此,ThV1Vo可能需要更大的可塑性,以便将V1结构域中的这些120°旋转步骤与Vo c12环中更小的每个c亚基步骤相关联在一起。在V-ATP酶中,这种额外的灵活性可能通过这些额外的外周茎部结构和连接亚基加以实现。我们解析出的新结构显示了这一点是如何实现的,这就为整个V-ATP酶家族提供了框架。”(生物谷 Bioon.com)
参考资料:
1.Long Zhou er al. Structure and conformational plasticity of the intact Thermus thermophilus V/A-type ATPase. Science, 2019, doi:10.1126/science.aaw9144.
2.Structure of protein nanoturbine revealed
https://phys.org/news/2019-08-protein-nanoturbine-revealed.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


