罗氏Perjeta/Herceptin SC剂型III期临床达到主要终点!
近日,罗氏宣布评估Perjeta与Herceptin固定剂量组合皮下(SC)注射制剂治疗HER2阳性早期乳腺癌(eBC)的III期临床研究FeDeriCa达到主要终点。这是一项国际性、多中心、双臂、随机、开放标签研究,在正接受新辅助治疗(术前)和辅助治疗(术后)的HER2阳性eBC患者中开展,评估了Perjeta与Herceptin固定剂量组合SC注射制剂联合化疗的药代动力学、疗效和安
FDA批准第4款Herceptin生物类似药Trazimera,这次来自Pfize
2019年3月11日,Pfizer宣布其研发的Herceptin生物类似药Trazimera获FDA批准上市,用于HER2过表达乳腺癌及HER2过表达转移性胃或胃食管交界腺癌的治疗,成为继Ogivri、Herzuma和Ontruzant之后,FDA批准的第4款Herceptin生物类似药。Herceptin(Trastuzumab)是一种抗HER2的靶向单抗药物,可用于治疗HER2阳性
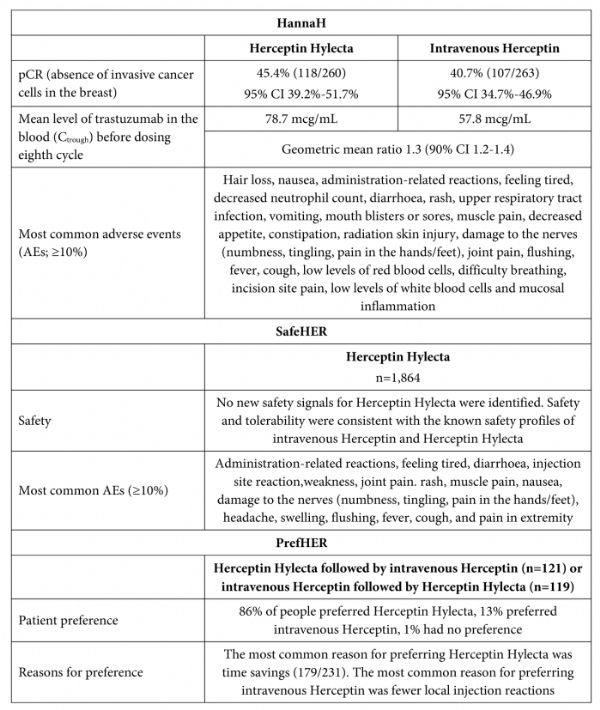
罗氏皮下注射剂型赫赛汀(Herceptin Hylecta)获美国FDA批准
2019年3月4日讯 /生物谷BIOON/ --瑞士制药巨头罗氏(Roche)近日宣布,美国食品和药物管理局(FDA)已批准Herceptin Hylecta(trastuzumab and hyaluronidase-oysk,曲妥珠单抗和透明质酸酶)皮下注射液,用于:(1)联合化疗用于治疗HER2阳性早期乳腺癌(淋巴结阳性,或淋巴结阳性且ER/PR阴性,或具有一个高危特征)患者;(2)单独或联
美FDA受理两种Herceptin仿制药的准入申请
近日,监管机构接受了安进(Amgen)和梯瓦旗下两种赫赛汀(Herceptin)仿制药的审批文件。对此,安进研发部门主管肖恩·哈珀(Sean Harper)将这一事件称做“令人振奋的里程碑”。但是,这对于罗氏来说无疑是一个坏消息,旗老牌癌症重磅药物即将面临专利到期的威胁。就在Mylan和Biocon的Herceptin生物类似药以及安进公司阿瓦斯汀(Avastin)仿制药获得推荐审批的
Avastin 和 Herceptin 生物类似物汹涌来袭,获 FDA 专家全票推荐批准
7 月 13 日对罗氏来说是黑暗的一天。FDA 肿瘤药物专家咨询委员会上午以 17:0 的投票结果推荐批准安进 / 艾尔建的 ABP 215(贝伐珠单抗类似物)上市,下午以 16:0 的投票结果推荐批准 Mylan/Bicon 的曲妥珠单抗类似物上市。专家一致认为,这两款类似物与原研药没有临床意义的差异。FDA 将在 9 月份之前依据专家组的意见对这两个类似物做出最终审批决定。需要特别指出的是,A
Puma抗癌药物neratinib临床效果优于Herceptin
Puma Biotechnology最近宣布公司开发的一种抗癌药物neratinib在治疗HER2阳性乳腺癌的临床研究中药效超过了现有的Herceptin。
印度部分撤销罗氏赫赛汀(Herceptin)专利
2013年8月5日讯 /生物谷BIOON/ --罗氏(Roche)发言人8月4日证实,印度已部分撤销该公司乳腺癌重磅药物赫赛汀(Herceptin)的专利。 瑞士报纸《Schweiz am Sonntag》报道称,印度加尔各答专利局已于7月17日撤销了赫赛汀的分案专利(divisional patents),理由是这些分案专利未正确提交。
印度Biocon预计Herceptin仿制药可于明年3月登陆印度市场
2013年8月26日讯 /生物谷BIOON/ --自从罗氏决定放弃寻求其治疗乳腺癌药物Herceptin在印度的专利保护期延长,印度本土各大制药企业都纷纷将目光集中在这种仿制药上。
CHMP建议批准罗氏皮下注射剂型Herceptin用于HER2阳性乳腺癌
2013年7月2日讯 /生物谷BIOON/ --罗氏6月28日宣布,皮下注射剂型赫赛汀(Herceptin)获得了欧盟委员会(EC)人用医药产品委员会(CHMP)的积极意见。CHMP建议批准皮下注射剂型Herceptin用于HER2阳性乳腺癌患者的治疗。 目前,Herceptin通过静脉注射给药,耗时30-90分钟。皮下注射剂型Herceptin则通过皮下注射给药,耗时仅为2-5分钟。