2020年1月CRISPR/Cas研究进展
来源:本站原创 2020-01-31 23:59
即将过去的2020年1月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
2020年1月31日讯/生物谷BIOON/---基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。

2018年11月26日,中国科学家贺建奎声称世界上首批经过基因编辑的婴儿---一对双胞胎女性婴儿---在11月出生。他利用一种强大的基因编辑工具CRISPR-Cas9对这对双胞胎的一个基因进行修改,使得她们出生后就能够天然地抵抗HIV感染。这也是世界首例免疫艾滋病基因编辑婴儿。这条消息瞬间在国内外网站上迅速发酵,引发千层浪。有部分科学家支持贺建奎的研究,但是更多的是质疑,甚至是谴责。
即将过去的1月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Nature:揭示为何大约40%的细菌缺乏CRISPR-Cas系统
doi:10.1038/s41586-020-1936-2
在一项新的研究中,来自英国埃克塞特大学、法国蒙彼利埃大学和新西兰奥塔哥大学的研究人员揭示了细菌免疫系统如何对它们的宿主有害,并解释了为何在许多细菌中没有发现它们。相关研究结果于2020年1月22日在线发表在Nature期刊上,论文标题为“Targeting of temperate phages drives loss of type I CRISPR–Cas systems”。
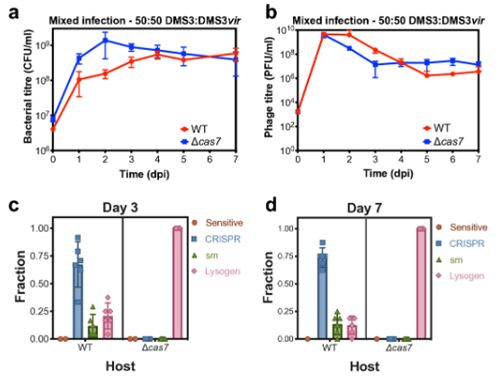
CRISPR-Cas是一种细菌免疫系统,可保护细菌免受病毒(称为噬菌体)的感染。这种免疫系统的作用机制是窃取一小段病毒DNA并在未来的感染中利用这段病毒DNA靶向和破坏匹配的病毒基因组部分。CRISPR-Cas的靶向作用会破坏这种病毒基因组,这意味着无法产生新的病毒拷贝。
论文第一作者、Westra实验室研究员Clare Rollie和Anne Chevallereau解释道,“我们的新结果表明这种细菌免疫系统无法消除溶原性噬菌体,并且在噬菌体感染期间经常导致对宿主有害的自身免疫反应。”
这种类型的自身免疫反应是由靶向整合到宿主基因组中的病毒DNA的CRISPR-Cas系统引起的,从而导致宿主细胞死亡和病毒释放。他们发现从基因组中丢失了CRISPR-Cas系统的细菌细胞避免了自身免疫靶向引起的损伤,得以存活和增殖。因此,缺乏这种关键的免疫系统是一种优势。
2.Nat Commun:干细胞、CRISPR以及基因测序共同帮助建立脑癌模型
doi:10.1038/s41467-020-14312-1
近日,加利福尼亚大学圣地亚哥分校医学院的研究人员使用基因工程化的人类多能干细胞,创建了一种新型的癌症模型,用于体内研究胶质母细胞瘤如何随时间发展和变化。
共同资深作者Frank B. Funari博士说:“我们已经开发出经过CRISPR改造的干细胞模型,在胶质母细胞瘤中具有与肿瘤相关的基因突变,携带该突变的细胞基本上具有患者来源肿瘤的所有特征,包括染色体外DNA扩增在内。”
在最近发表在《Nature Communications》杂志上的文章中,研究人员使用CRISPR编辑技术在原本正常的基因组中进行了靶向突变,从而创造了可促进肿瘤发展的遗传变异。接受改造的肿瘤细胞在行为,病理学,转录组特征以及遗传突变进化等方面表现得与4级神经胶质瘤十分相似。
共同资深作者Gene W. Yeo说:“单细胞RNA测序和计算工具的加入使得我们能够通过大数据分析真正评估体内肿瘤的异质性。”
3.Nat Med:基因疗法治疗杜氏肌营养不良症
doi:10.1038/s41591-019-0738-2
杜氏肌营养不良症(DMD)是儿童中最常见的遗传性肌肉疾病。对此,慕尼黑工业大学(TUM)等机构的研究人员开发出一种基因疗法,可以为患有DMD的患者提供永久性的缓解。
Dystrophin蛋白是肌肉组织再生的关键。患有杜氏肌营养不良症的人由于基因突变,缺乏这种必需的蛋白质,因此他们的肌肉细胞会随着时间的流逝而退化,并逐渐被结缔组织和脂肪组织取代。 DMD主要影响男性,因为关键的突变位点位于X染色体上。
由TUM的科学家通过优化Crispr-Cas9基因编辑技术,首次成功地修复了猪中突变的肌营养不良蛋白基因。TUM和德国环境健康研究中心的遗传学家Wolfgang Wurst教授说:“这些基因剪刀非常有效,并且可以纠正肌营养不良蛋白基因。”与没有接受该治疗的疾病动物相比,所治疗的动物对心律不齐的敏感性较低,并且预期寿命增加。
4.Circulation:CRISPR/Cas9基因编辑或可用于治疗LDLR突变型家族性高胆固醇血症
doi:10.1161/CIRCULATIONAHA.119.042476
低密度脂蛋白(LDL)受体(LDLR)突变是家族性高胆固醇血症的主要原因之一,可诱发动脉粥样硬化,使携带者具有较高的终生心血管疾病风险。CRISPR/Cas9系统是基因编辑纠正基因突变从而改善疾病的有效工具。
通过CRISPR/Cas9系统对体内体细胞进行基因编辑是否可治愈由Ldlr突变引起的家族性高胆固醇血症?本研究在小鼠模型中对此进行研究。研究人员基于相对应的家族性高胆固醇血症相关基因突变建立了一种无义点突变的鼠系——LdlrE208X。采用腺病毒(AAV)-CRISPR/Cas9校正肝细胞Ldlr基因上的点突变。
研究人员发现纯合突变的LdlrE208X小鼠(6只)经高脂膳食喂养后表现为严重的动脉粥样硬化表型,经AAV-CRISPR/Cas9治疗后部分肝细胞的Ldlr突变得到纠正,LDLR蛋白的表达部分恢复(6只)。与对照组相比(每组6只),靶向单导RNA的AAV-CRISPR/Cas9组(6只)的血清总胆固醇、总甘油三酯和低密度脂蛋白胆固醇均显著降低,而且主动脉粥样硬化斑块较小,巨噬细胞浸润程度较低。
5.Nat Commun:新型CRISPR基因编辑技术可用于靶向扩增的抗生素抗性基因
doi:10.1038/s41467-019-13649-6
美国加利福尼亚大学圣地亚哥分校的科学家们开发了新型基于CRISPR的基因驱动系统Pro-AG,该系统显着提高了灭活细菌耐药性基因的效率。该研究于12月16日发表在《Nature communications》杂志上。
抗生素的广泛使用已导致环境中抗菌素耐药性的上升。健康专家预测,在未来几十年中,抗生素耐药性的威胁可能会急剧增加,如果不加控制,到2050年每年将导致约一千万的耐药性疾病死亡。
Pro-AG是基于CRISPR-Cas9基因编辑技术的改进。Pro-AG系统解决了一个棘手的问题,即以质粒,环状DNA形式存在的抗生素耐药性,这种环状DNA可以独立于细菌基因组复制。携带抗生素抗性基因的质粒的多拷贝或"扩增质粒"可以存在于每个细菌中,并具有在细菌之间转移抗生素抗性的能力,从而对成功治疗提出了艰巨的挑战。Pro-AG通过插入修复机制来破坏抗生素抗性基因的活性,其效率比目前的插入和破坏方法高至少两个数量级。
6.PNAS:利用CRISPR-Cas9模拟小细胞肺癌中的靶基因突变
doi:10.1073/pnas.1821893117
小细胞肺癌(SCLC)是一种致命疾病,由于缺乏有效的新疗法,其治疗效果在30多年来未显着改善。大规模测序研究已经在人SCLC肿瘤中鉴定出许多反复突变的基因,其功能仍知之甚少。
在一项新的研究中,来自美国麻省理工学院的研究人员对CRISPR-Cas9系统进行改进,以快速地模拟SCLC小鼠模型中的靶基因突变。通过使用这种系统,他们发现基因p107在SCLC中起着肿瘤抑制基因的作用。此外,p107的丧失赋予了与p107存在密切同源关系的p130的丧失引发的肿瘤表型。这些研究结果表明,这种系统可用于更好地了解有助于SCLC进展的遗传因素。
7.Nat Commun:揭示CRISPR-Cas9系统在非人类灵长类动物中不会导致明显的脱靶效应
doi:10.1038/s41467-019-13481-y
CRISPR-Cas9是一种广泛使用的基因组编辑工具,但其脱靶效应和在靶复杂突变仍然令人担忧,尤其是考虑到未来的临床应用。非人类灵长类动物与人类有着密切的遗传和生理相似性,这使得它们成为开发基于Cas9的疗法的理想临床前模型。但是,尚未在非人类灵长类动物中进行全面的体内脱靶评估和在靶评估。
在一项新的研究中,来自中国科学院昆明动物研究所和中国科学院上海营养与健康研究所的研究人员对经过CRISPR-Cas9处理的恒河猴进行全基因组三重测序。他们仅发现少量的可用预期的自发突变来解释的新生突变,并未检测到意料之外的脱靶突变。此外,长读取测序数据未检测到靶区域中的较大结构变异。(生物谷 Bioon.com)

图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
即将过去的1月份,有哪些重大的CRISPR/Cas研究或发现呢?小编梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
1.Nature:揭示为何大约40%的细菌缺乏CRISPR-Cas系统
doi:10.1038/s41586-020-1936-2
在一项新的研究中,来自英国埃克塞特大学、法国蒙彼利埃大学和新西兰奥塔哥大学的研究人员揭示了细菌免疫系统如何对它们的宿主有害,并解释了为何在许多细菌中没有发现它们。相关研究结果于2020年1月22日在线发表在Nature期刊上,论文标题为“Targeting of temperate phages drives loss of type I CRISPR–Cas systems”。

图片来自Nature, 2020, doi:10.1038/s41586-020-1936-2。
CRISPR-Cas是一种细菌免疫系统,可保护细菌免受病毒(称为噬菌体)的感染。这种免疫系统的作用机制是窃取一小段病毒DNA并在未来的感染中利用这段病毒DNA靶向和破坏匹配的病毒基因组部分。CRISPR-Cas的靶向作用会破坏这种病毒基因组,这意味着无法产生新的病毒拷贝。
论文第一作者、Westra实验室研究员Clare Rollie和Anne Chevallereau解释道,“我们的新结果表明这种细菌免疫系统无法消除溶原性噬菌体,并且在噬菌体感染期间经常导致对宿主有害的自身免疫反应。”
这种类型的自身免疫反应是由靶向整合到宿主基因组中的病毒DNA的CRISPR-Cas系统引起的,从而导致宿主细胞死亡和病毒释放。他们发现从基因组中丢失了CRISPR-Cas系统的细菌细胞避免了自身免疫靶向引起的损伤,得以存活和增殖。因此,缺乏这种关键的免疫系统是一种优势。
2.Nat Commun:干细胞、CRISPR以及基因测序共同帮助建立脑癌模型
doi:10.1038/s41467-020-14312-1
近日,加利福尼亚大学圣地亚哥分校医学院的研究人员使用基因工程化的人类多能干细胞,创建了一种新型的癌症模型,用于体内研究胶质母细胞瘤如何随时间发展和变化。
共同资深作者Frank B. Funari博士说:“我们已经开发出经过CRISPR改造的干细胞模型,在胶质母细胞瘤中具有与肿瘤相关的基因突变,携带该突变的细胞基本上具有患者来源肿瘤的所有特征,包括染色体外DNA扩增在内。”
在最近发表在《Nature Communications》杂志上的文章中,研究人员使用CRISPR编辑技术在原本正常的基因组中进行了靶向突变,从而创造了可促进肿瘤发展的遗传变异。接受改造的肿瘤细胞在行为,病理学,转录组特征以及遗传突变进化等方面表现得与4级神经胶质瘤十分相似。
共同资深作者Gene W. Yeo说:“单细胞RNA测序和计算工具的加入使得我们能够通过大数据分析真正评估体内肿瘤的异质性。”
3.Nat Med:基因疗法治疗杜氏肌营养不良症
doi:10.1038/s41591-019-0738-2
杜氏肌营养不良症(DMD)是儿童中最常见的遗传性肌肉疾病。对此,慕尼黑工业大学(TUM)等机构的研究人员开发出一种基因疗法,可以为患有DMD的患者提供永久性的缓解。
Dystrophin蛋白是肌肉组织再生的关键。患有杜氏肌营养不良症的人由于基因突变,缺乏这种必需的蛋白质,因此他们的肌肉细胞会随着时间的流逝而退化,并逐渐被结缔组织和脂肪组织取代。 DMD主要影响男性,因为关键的突变位点位于X染色体上。
由TUM的科学家通过优化Crispr-Cas9基因编辑技术,首次成功地修复了猪中突变的肌营养不良蛋白基因。TUM和德国环境健康研究中心的遗传学家Wolfgang Wurst教授说:“这些基因剪刀非常有效,并且可以纠正肌营养不良蛋白基因。”与没有接受该治疗的疾病动物相比,所治疗的动物对心律不齐的敏感性较低,并且预期寿命增加。
4.Circulation:CRISPR/Cas9基因编辑或可用于治疗LDLR突变型家族性高胆固醇血症
doi:10.1161/CIRCULATIONAHA.119.042476
低密度脂蛋白(LDL)受体(LDLR)突变是家族性高胆固醇血症的主要原因之一,可诱发动脉粥样硬化,使携带者具有较高的终生心血管疾病风险。CRISPR/Cas9系统是基因编辑纠正基因突变从而改善疾病的有效工具。
通过CRISPR/Cas9系统对体内体细胞进行基因编辑是否可治愈由Ldlr突变引起的家族性高胆固醇血症?本研究在小鼠模型中对此进行研究。研究人员基于相对应的家族性高胆固醇血症相关基因突变建立了一种无义点突变的鼠系——LdlrE208X。采用腺病毒(AAV)-CRISPR/Cas9校正肝细胞Ldlr基因上的点突变。
研究人员发现纯合突变的LdlrE208X小鼠(6只)经高脂膳食喂养后表现为严重的动脉粥样硬化表型,经AAV-CRISPR/Cas9治疗后部分肝细胞的Ldlr突变得到纠正,LDLR蛋白的表达部分恢复(6只)。与对照组相比(每组6只),靶向单导RNA的AAV-CRISPR/Cas9组(6只)的血清总胆固醇、总甘油三酯和低密度脂蛋白胆固醇均显著降低,而且主动脉粥样硬化斑块较小,巨噬细胞浸润程度较低。
5.Nat Commun:新型CRISPR基因编辑技术可用于靶向扩增的抗生素抗性基因
doi:10.1038/s41467-019-13649-6
美国加利福尼亚大学圣地亚哥分校的科学家们开发了新型基于CRISPR的基因驱动系统Pro-AG,该系统显着提高了灭活细菌耐药性基因的效率。该研究于12月16日发表在《Nature communications》杂志上。
抗生素的广泛使用已导致环境中抗菌素耐药性的上升。健康专家预测,在未来几十年中,抗生素耐药性的威胁可能会急剧增加,如果不加控制,到2050年每年将导致约一千万的耐药性疾病死亡。
Pro-AG是基于CRISPR-Cas9基因编辑技术的改进。Pro-AG系统解决了一个棘手的问题,即以质粒,环状DNA形式存在的抗生素耐药性,这种环状DNA可以独立于细菌基因组复制。携带抗生素抗性基因的质粒的多拷贝或"扩增质粒"可以存在于每个细菌中,并具有在细菌之间转移抗生素抗性的能力,从而对成功治疗提出了艰巨的挑战。Pro-AG通过插入修复机制来破坏抗生素抗性基因的活性,其效率比目前的插入和破坏方法高至少两个数量级。
6.PNAS:利用CRISPR-Cas9模拟小细胞肺癌中的靶基因突变
doi:10.1073/pnas.1821893117
小细胞肺癌(SCLC)是一种致命疾病,由于缺乏有效的新疗法,其治疗效果在30多年来未显着改善。大规模测序研究已经在人SCLC肿瘤中鉴定出许多反复突变的基因,其功能仍知之甚少。
在一项新的研究中,来自美国麻省理工学院的研究人员对CRISPR-Cas9系统进行改进,以快速地模拟SCLC小鼠模型中的靶基因突变。通过使用这种系统,他们发现基因p107在SCLC中起着肿瘤抑制基因的作用。此外,p107的丧失赋予了与p107存在密切同源关系的p130的丧失引发的肿瘤表型。这些研究结果表明,这种系统可用于更好地了解有助于SCLC进展的遗传因素。
7.Nat Commun:揭示CRISPR-Cas9系统在非人类灵长类动物中不会导致明显的脱靶效应
doi:10.1038/s41467-019-13481-y
CRISPR-Cas9是一种广泛使用的基因组编辑工具,但其脱靶效应和在靶复杂突变仍然令人担忧,尤其是考虑到未来的临床应用。非人类灵长类动物与人类有着密切的遗传和生理相似性,这使得它们成为开发基于Cas9的疗法的理想临床前模型。但是,尚未在非人类灵长类动物中进行全面的体内脱靶评估和在靶评估。
在一项新的研究中,来自中国科学院昆明动物研究所和中国科学院上海营养与健康研究所的研究人员对经过CRISPR-Cas9处理的恒河猴进行全基因组三重测序。他们仅发现少量的可用预期的自发突变来解释的新生突变,并未检测到意料之外的脱靶突变。此外,长读取测序数据未检测到靶区域中的较大结构变异。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


